部分中学化学常见元素原子结构及性质如下表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子最外层电子数是内层电子总数的1/5 |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
(1)A元素在周期表中的位置为_______________________________________________。
(2)B与C形成的化合物的化学式为_______________________________________,它属于________(填“离子”或“共价”)化合物。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是__________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________________性,N的结构式为______________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱:________________________________________________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):______________________________________________________________。
(1)第四周期第Ⅷ族
(2)Mg3N2 离子
(3)①分别取X、Y各少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(合理即可)
②碱 HNHNHH
(4)4NH3+3O2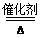 2N2+6H2O(合理即可)
2N2+6H2O(合理即可)
(5)Si-4e-+6OH-=SiO32-+3H2O
根据表格中提供的信息,可以推断A为Fe、B为Mg、C为N、D为Si、E为O、F为H。
(1)Fe位于第四周期第Ⅷ族。
(2)Mg与N形成的化合物为Mg3N2,属于离子化合物。
(3)①可以利用MnO2能够催化分解H2O2产生氧气区别H2O、H2O2;②H2O、H2O2的电子数分别为10、18,N和H形成的10个电子和18个电子的化合物分别为NH3和N2H4,其中N2H4的结构式为HNHNHH。
(4)O2的氧化性强于N2,可以通过单质的置换反应验证。
(5)Mg、Si的单质用导线连接插入NaOH溶液中可以形成原电池,Si作负极,电极反应式为Si-4e-+6OH-=SiO32-+3H2O。
