问题
选择题
一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:A(g)+3B(g)⇌2C(g)经2分钟反应达到平衡,此时生成0.2mol C.下列说法正确的是( )
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L⋅min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合下面示意图
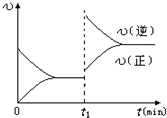
答案
A、2min平衡时C的物质的量为0.2mol,由方程式可知△n(B)=0.2mol×
=0.3mol,故v(B)=3 2
=0.075mol/(L⋅min),故A错误;0.3mol 2L 2min
B、平衡时C的物质的量为0.2mol,由方程式可知△n(A)=0.2mol×
=0.1mol,平衡时A的转化率为1 2
×100%=10%,故B错误;0.1mol 1mol
C、其他条件不变,升高温度,A的体积分数增大,说明平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,即△H<0,故C正确;
D、其他条件不变,增大压强,平衡向正反应移动,改变条件瞬间,正、逆速率都增大,且正反应速率增大更多,图象中改变条件瞬间,逆反应速率增大更多,平衡向逆反应移动,图象与实际不符,故D错误;
故选C.
