合成氨反应过程中的能量变化如图所示,据图回答下列问题:
(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点______(填升高、降低或不变),理由是______;
(2)该反应平衡常数表达式为:K=______,当浓度商Q______K(填“<”、“>”或“=”)时,反应向右进行.
(3)450℃时该反应的平衡常数______500℃时的平衡常数(填“<”、“>”或“=”).
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的措施是______(填字母代号).
a.高温高压 b.加入催化剂 c.增加N2的浓度
d.增加H2的浓度 e.分离出NH3
(5)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应物转化率 | a1 | a2 | a3 |
A.c1<c2 B.2c1<c3 C.a1+a2=1 D. a2<a3.
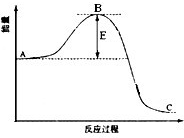
(1)催化剂是通过降低反应的活化能来加快化学反应速率的,所以加活性铁会使图中B点降低,故答案为:降低;因为催化剂改变了反应的历程使活化能E降低;
(2)合成氨的平衡常数表达式为:K=
,根据K和Q的关系,当浓度商Q<K时,反应向右进行,直到达到平衡状态,故答案为:[NH3]2 [N2][H2]3
;<;[NH3]2 [N2][H2]3
(3)合成氨的反应是放热反应,当温度升高,则平衡常数减小,故答案为:>;
(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,即让化学平衡正向进行即可,可以增加反应物N2的浓度、分离出NH3(减小生成物的浓度),高温条件会使平衡向左进行,加入催化剂不会改变反应物的转化率,增加H2的浓度会使得氢气的转化率减小,故答案为:ce;
(5)根据等效原理:投入物质1molN2、3molH2和2molNH3是等效的,所以a1+a2=1,c1=c2,投入4mol的氨气,是甲和乙投入量的2倍,但是压强增大的同时,化学平衡会向正向移动,所以2c1<c3,
故答案为:BC.
