X、Y、Z、W四种短周期元素在元素周期表的位置如图。其中W的原子序数是Y的2倍。
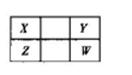
(1)W离子的结构示意图为____________。
(2)X的最简单氢化物与Cl2发生取代反应的化学方程式为(写一个)________________。
(3)能证明X、Z两元素非金属性强弱的离子方程式为__________________________。
(4)一定条件下,在密闭容器中,充入一定量的XY2(g)和XY (g),发生反应:
WY2(g)+2XY(g) 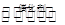 2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
2XY2 (g)+W(1)。T1oC时,各物质的平衡浓度如下表:
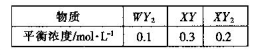
②若温度升高到T2oC时,反应的平衡常数为6.64,则该反应的正反应为_______反应(填 “吸热”或“放热”)。
(5)① 25℃、101 kPa,l mol金属镁完全燃烧放出300.0 kJ热量,1 mol单质X完全燃烧放出393.5 kJ热量。金属镁与X的最高价氧化物反应的热化学方程式为_________。
②室温下,Mg(OH) 2饱和溶液_________(填“能”或“不能”)使酚酞试液变红,通过计算说明原因(已知:Ksp[Mg(OH) 2]=4.0×10-12)。答__________________________
(1)
(2)CH4 + Cl2 → CH3Cl+HCl
(3)CO2+SiO32-+H2O= CO32-+H2SiO3↓
(4)吸热
(5)2Mg(s)+ CO2(g) =" 2MgO(s)+C(s)" △H=-206.5kJ/mol
(6)能 Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-)
1/2c3(OH-)= 4.0×10-12
c(OH-) =2.0×10-4
pOH=3.7
pH=14-3.7=10.3
酚酞的变色范围为8.2——10,故变红。
题目分析:W、Y同主族,且W的原子序数是Y的2倍,只有O、S符合,X、Y、Z、W分别为C、O、Si、S。(2)X的最简单氢化物为甲烷,甲烷与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4;(3)比较元素非金属性强弱可以根据最高价氧化物对应水化物酸性、与氢气化合的能力、氢化物稳定性及单质的置换反应;能证明X、Z两元素非金属性强弱的反应可以从强酸制弱酸和常温条件下的单质置换反应处理,本题可根据碳酸生成硅酸得出结论;
(4)该条件下平衡常数k=c2(XY2)/ c2(XY) c(WY2)=4.44<6.64,升高温度平衡正向移动,反应吸热;
(5)①Mg(s)+1/2O2(g)=" MgO(s)" △H="-300.0" kJ/mol
②C(s)+O2(g)= CO2(g) △H="-393.5" kJ/mol
①×2-②得出2Mg(s)+ CO2(g) =" 2MgO(s)+C(s)" △H=-206.5kJ/mol
②Ksp[Mg(OH)2]=4.0×10-12=c(Mg2+)×c2(OH-) 1/2c3(OH-)= 4.0×10-12 c(OH-) =2.0×10-4
pOH=3.7 pH=14-3.7=10.3 酚酞的变色范围为8.2——10,故变红。
