下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
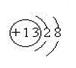
(1)请画出元素⑥的离子结构示意图: 。
(2)元素⑦中质子数和中子数相等的同位素符号是: 。
(3)④、⑤、⑦的离子半径由大到小的顺序为: 。
(4)②的最高价氧化物对应水化物的电离方程式为: 。
(5)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为: 。
(6)由表中两种元素形成的5核10电子分子常做燃料电池的燃料,该电池在碱性条件下的负极反应式为: 。
(7)由表中两种元素形成的氢化物A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料;B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838kJ热量,写出A与B反应的热化学方程式: 。
 (1)
(1) 
(2)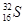 (或32S) …… 1分
(或32S) …… 1分
(3)S2->O2-> Na+ …… 1分
(4)H2CO3⇋ HCO3- + H+ HCO3- ⇋ CO32- + H+ …… 1分(只写一步也给分)
(5)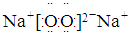 …… 1分
…… 1分
(6)CH4-8e-+10OH-= CO32-+7H2O …… 2分
(7)N2H4(l)+2H2O2(l) = 4H2O(l)+N2(g) ΔH="-1676" kJ/mol …… 2分
题目分析:(1)⑥元素为第三周期第三主族元素铝,原子序数为13,其离子结构示意图为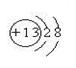
(2)元素⑦为S元素,质子数和中子数相等,则质量数是32,其同位素符号是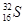 (或32S),
(或32S),
(3)④、⑤、⑦的离子分别是O2-、Na+、S2-,根据半径的大小主要由电子层数、核电荷数决定,电子层数越多半径越大,核电荷数越多半径越小,所以3种离子的半径大小顺序为S2->O2-> Na+,
(4)②为碳元素,最高价氧化物对应水化物为碳酸,属于弱酸,其电离方程式为:H2CO3⇋ HCO3- + H+ HCO3- ⇋ CO32- + H+,
(5)④、⑤两种元素分别为氧、钠元素,原子按1:1组成的化合物为Na2O2,其电子式为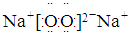
(6)由表中两种元素形成的5核10电子分子应是CH4,该电池在碱性条件下的负极反应式为:CH4-8e-+10OH-= CO32-+7H2O
(7)A和B都含有18个电子,A是一种6原子分子,可做火箭发动机燃料,则A为N2H4, B是一种常见强氧化剂,则B为H2O2, 根据所给数据可得A与B反应的热化学方程式:N2H4(l)+2H2O2(l) = 4H2O(l)+N2(g) ΔH="-1676" kJ/mol
