三种短周期元素X、Y、Z,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体。已知X原子的最外层电子数是内层电子数的3倍,X和Y的单质直接化合形成气体A,X和Z的单质直接化合形成液态化合物B,Y和Z的单质直接化合形成的化合物C是一种无色有刺激性气味的气体。
请回答下列问题:
(1)Y元素在周期表中的位置是 。
(2)C可在X的单质中燃烧得到Y的单质和化合物B,利用此反应可制成新型的化学电源(KOH溶液做电解质溶液),两个电极均由多孔碳制成,通人的气体由孔隙中逸出,并在电极表面放电,则正极通入的物质是 (填物质名称);负极的电极反应式为 。
(3)C与X的单质反应生成A的化学方程式为 。
(4)常温下,C的水溶液的pH=12,则该溶液中由水电离的C(OH-)= 。若向C溶液中加入等体积、等物质的量浓度的盐酸,所得溶液中水的电离程度 (填“大于”、“等于”或“小于”)相同条件下C溶液中水的电离程度。
(5)在2L密闭容器中放入1molC气体,在一定温度进行如下反应:
2C(g) 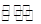 Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
Y2(g)+3Z2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P l00 kPa | 4 | 4.6 | 5.4 | 5.8 | 6 | 6 |
该反应的化学平衡常数表达式是 (用具体物质的化学式表示);平衡时C的转化率为 。
(6)已知:①Y2(g)+2X2(g)=2YX2(g) 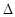 H=+67.7 kJ·mol-1。
H=+67.7 kJ·mol-1。
②Y2Z4(g)+X2(g)=Y2(g)+2Z2X(g) 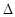 H="-534" kJ·mol-1。
H="-534" kJ·mol-1。
则2Y2Z4(g)+2YX2(g)=3Y2(g)+4Z2X(g) 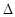 H= kJ·mol-1
H= kJ·mol-1
(1)第2周期VA族(2)氧气 4NH3-12e-+12OH-=2N2+12H2O
(3)4NH3+5O2 4NO+6H2O(4)10-12mol/L;大于;(5)k=[N2][H2]3/[NH3]2 50℅ (6)-1135.7
4NO+6H2O(4)10-12mol/L;大于;(5)k=[N2][H2]3/[NH3]2 50℅ (6)-1135.7
题目分析:由X原子的最外层电子数是内层电子数的3倍可得X为O,X和Z的单质直接化合形成液态化合物B可得Z为H,根据短周期元素X、Y、Z原子序数和为16可得Y为N,故Y为第二周期VA族;(2)原电池的正极发生还原反应,负极发生氧化反应,通入的氧气发生还原反应,故正极通入的是氧气,负极通入的是氨气,氨气发生氧化反应生成氮气,电解质溶液呈碱性,故氢氧根离子参与反应生成N2和水;(3)氨气发生催化氧化生成氮气和水;(4)氨水中氢离子是水电离生成的,故溶液中氢离子的浓度等于由水电离生成的氢氧根离子的浓度;氨水中加入盐酸,会反应生成氯化铵,铵根离子水解,使水的电离程度增大。(5)平衡常数的表达式是产物平衡浓度的系数次方的乘积除以反应物平衡浓度系数次方的乘积,注意固体和纯液体不能写入平衡常数表达式中;起始时气体的物质的量是1mol,对应压强是4,当压强是6时,对应气体的总物质的量是1.5mol,设C的转化量为x,则可得1-x+0.5x+1.5x=1.5,故x等于0.5mol,转化率为50℅;根据盖斯定律,2②-①可得要求的反应,故-534×2-67.7=-1135.7。
