已知反应:2SO2(g)+O2(g)⇌2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )

A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
A、二氧化硫起始浓度为
=0.2mol/L,由甲图可知A点SO2的转化率为0.8,所以△c(SO2)=0.8×0.2mol/L=0.16mol/L,故二氧化硫的平衡浓度为0.2mol/L-0.16mol/L=0.04mol/L,故A错误;2mol 10L
B、由甲图可知B点SO2的转化率为0.85,所以△c(SO2)=0.85×0.2mol/L=0.17mol/L,则:
2SO2(g)+O2(g)⇌2SO3(g)
开始(mol/L):0.2 0.1 0
变化(mol/L):0.17 0.085 0.17
平衡(mol/L):0.03 0.015 0.17
所以B点SO2、O2、SO3的平衡浓度之比为0.03:0.015:0.17=6:3:34,故B错误;
C、达平衡后,缩小容器容积,反应混合物的浓度都增大,正、逆反应速率都增大,体系压强增大,平衡向体积减小的反应移动,即平衡向正反应移动,故V(正)>V(逆),故C正确;
D、由到达平衡的时间可知,温度为T1,先到达平衡,反应速率快,温度越高反应速率越快,故T2<T1,故D错误;
故选C.

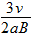 ,正电荷
,正电荷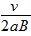 ,正电荷
,正电荷 ,负电荷
,负电荷 ,负电荷
,负电荷