X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系。回答下列问题:
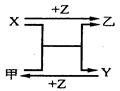
(1) 若X基态原子外围电子排布式为3s2,甲是由第二周期两种元素的原子构成的气态化合物分子, Y基态原子的轨道表示式为 ,甲的电子式为
(2)若X原子的价电子排布为ns(n-1)np(n+2),常温下Y为易挥发的液体物质、乙为无色易溶于水的气体。则Z为 ,组成Y的元素的基态原子的电子排布式为 。
(3)若X、Y均为金属单质,X基态原子外围电子排布式为3s23p1,甲为具有磁性的黑色固体,则X与甲反应的化学方程式为: ,Y2+离子的电子排布式为 。
(1)1s2 2s2
2s2 2p2
2p2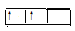 CO2的电子式
CO2的电子式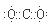
(2)H2;[Ar]3d104s24p5
(3)8Al+3Fe3O4 9Fe+ 4Al2O3 [Ar]3d6
9Fe+ 4Al2O3 [Ar]3d6
题目分析:(1)X基态原子外围电子排布式为3s2,则X的核外电子数为12,所以X为镁,与镁反应的气态化合物应为二氧化碳,则甲为二氧化碳,Y为碳单质。所以Y的基态原子的轨道表示式为1s2 2s2
2s2 2p2
2p2 ,二氧化碳的电子式为
,二氧化碳的电子式为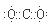
(2)X原子的价电子排布为ns(n-1)np(n+2),则n-1=2,n=3,X的最外层电子排布为3s23p5,X为氯气;常温下Y为易挥发的液体物质,则Y为液溴;常温下乙为无色易溶于水的气体,乙为氯化氢,Z为氢气;溴是35号元素,其基态原子的电子排布式为[Ar]3d104s24p5
(3)X基态原子外围电子排布式为3s23p1,X为铝单质;甲为具有磁性的黑色固体,甲为四氧化三铁,X与甲反应即铝热反应,化学方程式为8Al+3Fe3O4 9Fe +4Al2O3 ,Y为铁单质,Fe2+的电子排布式为[Ar]3d6
9Fe +4Al2O3 ,Y为铁单质,Fe2+的电子排布式为[Ar]3d6
