下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 | A | B | C | D | E | F | G | H | I | J |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
试回答下列问题:
(1)以上10种元素中第一电离能最小的是______(填编号)。
(2)写出下列有关反应的化学方程式:
①E的单质与I元素的最高价氧化物对应的水化物的浓溶液在加热条件下的反应:____________________;
②H2C2与EC2反应:_____________________________________________ 。
(3)上述E、F、G三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的是________(写分子式)。比元素B原子序数大5的元素基态原子电子排布式是__________________。
(4)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中E元素原子以____________和__________杂化成键,分子中共形成____________个σ键,__________个π键。
(5)C和I相比较,非金属性较弱的是________(填元素名称),可以验证你的结论的是下列中的________(填编号)。
a.气态氢化物的稳定性和挥发性
b.单质分子中的键能
c.两元素的电负性
d.含氧酸的酸性
e.氢化物中X—H键的键长(X代表C和I两元素)
f.两单质在自然界的存在
(1)B
(2)①C+4HNO3(浓) CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
②2Na2O2+2CO2=2Na2CO3+O2
(3)PCl3或CCl4 1s22s22p63s23p63d54s1或[Ar]3d54s1
(4)sp3 sp2 7 1 (5)氮 ce
由题意得A~J分别为S、K、O、Al、C、P、Cl、Na、N、Si,由电
离能的比较规律可得B的第一电离能最小。E、F、G分别为C、P、Cl,能
组成CCl4和PCl3,其电子式为 ·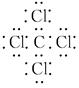
 , 均满足8电子
, 均满足8电子
稳定结构。E、C和氢组成的一元羧酸为CH3COOH,其结构式为
 ,C原子的杂化类型分别为sp3和sp2。O和N元素比较,
,C原子的杂化类型分别为sp3和sp2。O和N元素比较,
O的非金属性大于N,可通过电负性和共价键的键长来判断。至于a项中的
挥发性不能说明非金属性的强弱,而b项中O2和N2分子中分别为O=O键
和N≡N键,N2反而更稳定,与结论相反。
