用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断______段化学反应速率最快,______段收集的氢气最多.
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是______,一定时间后反应速率逐渐减慢,其原因是______.
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是______
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸 E.降低温度
(4)EF段产生H2的反应速率为______mL•min-1.
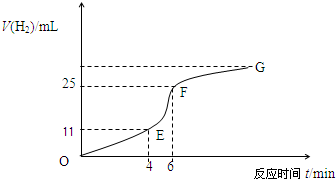
(1)根据纵坐标的高低判断收集气体的多少,纵坐标越高,收集的气体越大,所以是EF段;根据图象斜率判断反应速率的大小,斜率越大,反应速率越快,所以是EF段,故答案为:EF段;EF段;
(2)影响EF段速率变化主要因素是:该反应是放热反应,温度越高,反应速率越快,所以温度的改变是改变反应速率的主要原因;影响FG段速率变化主要因素是:随着反应的进行,盐酸的浓度逐渐减小,浓度越小,反应速率越小,所以浓度的改变是改变反应速率的主要原因;
故答案为:该反应是放热反应,温度升高,反应速率加快;随着反应的进行,盐酸的浓度逐渐减小,反应速率逐渐减小.
(3)反应物的浓度越大,反应速率越快,所以只要使反应物浓度变小即可.
A、加蒸馏水,盐酸浓度变小,反应速率减小,故A正确;
B、加氯化钠固体,盐酸浓度不变,反应速率不变,故B错误;
C、加氯化钠溶液,溶液体积增大,盐酸浓度降低,反应速率减小,故C正确;
D、加浓盐酸,盐酸浓度增大,反应速率加快,故D错误;
E、温度降低,化学反应速率减小,故E正确;
故答案为:ACE;
(3)因V=
=△V △t
=7.0ml•min-1,故答案为:7.0.14ml 2min
