I.已知几种元素原子的价电子构型为3s2,4s2,4s24p1,3d54s2,3s23p3,它们分别属于第几周期?第几族?最高化合价是多少?各元素符号分别是什么?
Ⅱ.第四周期的A、B、C、D四种元素,其价电子数依次为1、2、2、7,其原子序数依次增大。已知A与B 的次外层电子数均为8,而C与D的次外层电子数均为18。根据原子结构,判断:
(1)A、B、C、D的元素符号分别是________、________、________、________。
(2)写出D与A的简单离子的电子排布式________,________。
(3)哪一种元素的氢氧化物碱性最强?__________________________________________。
(4)B与D两原子间能形成何种化合物?________________。写出化学式及电子式________________,________________。
Ⅰ.Mg 第3周期ⅡA族、+2;Ca 第4周期ⅡA族、+2;Ga 第4周期ⅢA族、+3;Mn 第4周期ⅦB族、+7;P 第3周期ⅤA族、+5。
Ⅱ.(1)K Ca Zn Br
(2)Br-:1s22s22p63s23p63d104s24p6 K+:1s22s22p63s23p6
(3)K
(4)离子化合物 CaBr2 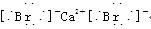
Ⅰ.根据价电子构型判断5种元素分别为Mg、Ca、Sc、Mn、P。Ⅱ.
根据A、B、C、D的原子结构判断分别为K、Ca、Zn、Br。
