第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、0四种元素的电负性由小到大的顺序为_____________________。
②下列叙述不正确的是_____________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以HCHO易溶于水
B.HCHO和CO2分子中的中心原子均采用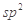 杂化
杂化
C.C6H6分子中含有6个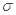 键和1个大
键和1个大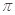 键,C2H2是非极性分子
键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是__________。
②六氰合亚铁离子[Fe(CN)6]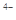 中不存在______________________________________。
中不存在______________________________________。
A.共价键 B.非极性键 C.配位键 D.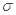 键 E.
键 E.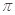 键
键
写出一种与CN-互为等电子体粒子的分子式_____________________。
(3) SO3分子的立体构型为_____________,SeO32-的立体构型为_______________。
(1)① H<C<N<O ② B C(每空2分)
(2)①分子或离子应有孤对电子(3分)② B (2分) CO (2分)
(3)平面正三角形 三角锥形 (每空2分)
题目分析:(1)①根据电负性的判断依据,H、C、N、0的电负性的大小顺序为H<C<N<O;②能形成氢键的元素是N、O、F,所以水与HCHO能形成氢键,正确;B、CO2分子中的中心原子采取sp杂化,错误;C、C6H6分子中含有12个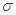 键,错误;D、CO2晶体属于分子晶体,二氧化硅属于原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,正确;答案选BC。
键,错误;D、CO2晶体属于分子晶体,二氧化硅属于原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,正确;答案选BC。
(2)①形成配合物的条件是一方提供空轨道,另一方提供孤对电子,所以与Fe原子或离子形成配合物的分子或离子应具备的结构特征是分子或离子中应有孤对电子②六氰合亚铁离子[Fe(CN)6]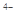 中亚Fe2+与CN-形成配位键,C与N之间形成1个
中亚Fe2+与CN-形成配位键,C与N之间形成1个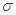 键、2个
键、2个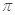 键,所以六氰合亚铁离子[Fe(CN)6]
键,所以六氰合亚铁离子[Fe(CN)6]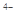 中不含非极性共价键,答案选B。等电子体是指原子总数和价电子总数均相同的微粒,CN-是2原子、10个价电子的粒子,与CN-互为等电子体粒子的有N2、CO等
中不含非极性共价键,答案选B。等电子体是指原子总数和价电子总数均相同的微粒,CN-是2原子、10个价电子的粒子,与CN-互为等电子体粒子的有N2、CO等
(3)SO3分子的价层电子对为3+1/2(6-3×2)=3+0,所以SO3分子的立体构型为平面正三角形,SeO32-的价层电子对为3+1/2(6+2-3×2)=3+1=4,所以SeO32-的立体构型为三角锥型
