问题
填空题
A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为________,D元素的原子结构示意图为_______。
(2)由A、B、C三种元素形成的化合物的电子式为________,这种化合物形成的晶体中所含的化学键类型有________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为__________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子的个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是________(用离子方程式表示)。
答案
(1)H2;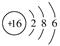 (2)
(2) 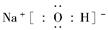 ;离子键、共价键 (3)H2SO3+H2O2=H2SO4+H2O (4)ClO-+H2O
;离子键、共价键 (3)H2SO3+H2O2=H2SO4+H2O (4)ClO-+H2O HClO+OH-
HClO+OH-
依据A、B、C、D、E元素的信息,可推导出A为氢,B为氧,C为钠,D为硫,E为氯,则A、B、C形成NaOH,其电子式为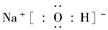 ,其中含离子键、共价键;H与O形成的H2O2和H、O、S形成的H2SO3能够发生氧化还原反应,化学方程式为H2O2+H2SO3=H2SO4+H2O。B、C、E形成NaClO,其溶于水因ClO-水解ClO-+H2OHClO+OH-而使溶液呈碱性。
,其中含离子键、共价键;H与O形成的H2O2和H、O、S形成的H2SO3能够发生氧化还原反应,化学方程式为H2O2+H2SO3=H2SO4+H2O。B、C、E形成NaClO,其溶于水因ClO-水解ClO-+H2OHClO+OH-而使溶液呈碱性。
