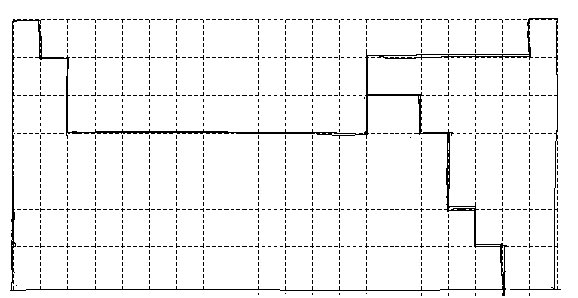
I.下面的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在下面的虚线框中用实线画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线。
II.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同周期,也不同族。X原子最外层电子数是核外电子层数的三倍,Y的最高价与最低价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)X元素位于元素周期表第 周期,第 族;
N元素位于元素周期表第 周期,第 族。
(2)请写出下列反应的离子方程式:
N单质与氢氧化钠溶液反应:
(3)Y与Z相比,非金属性较强元素的原子结构示意图为 ,可以证明该结论的实验是(用离子方程式表示)
(4)请将X、Z、M、N元素原子半径从大到小排序:
Ⅰ如下图
II(1)X、Y、Z、M、N分别为:氧、氯、硫、氢、硅元素。氧是第2周期,第VIA族;硅是第三周期,第IVA族(每空1分,共4分)
(2)Si+2OH-+H2O="Si" O32-+2H2(2分)
(3)氯元素的原子结构示意图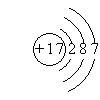 (1分)S2-+Cl2=S+2Cl-(2分)
(1分)S2-+Cl2=S+2Cl-(2分)
(4)N>Z>X>M (硅>硫>氧>氢) (1分)
题目分析:Ⅰ根据元素周期表的结构,画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线即可
II(1)X原子最外层电子数是核外电子层数的三倍,X若为3层电子,则最外层电子为9个电子,不符合电子排布规律,所以X为2层电子,最外层6个,所以X为O元素,位于元素周期表第2周期,第VIA族;Z为S元素,Y的最高价与最低价的代数和等于6,所以Y是氯元素,N是短周期主族元素中原子半径最大的非金属元素,所以N是Si元素,位于元素周期表第三周期,第IVA族
(2)硅与氢氧化钠溶液反应,生成硅酸钠和氢气,离子方程式为Si+2OH-+H2O=SiO32-+2H2↑
(3)Y是氯元素,Z为S元素,氯与硫相比,氯的非金属性强,其原子结构示意图为
将氯气通入硫化钠溶液中,有淡黄色浑浊出现,即可证明。发生的离子方程式为S2-+Cl2=S+2Cl-
(4)根据原子半径的比较规律电子层数越多核电荷数越少半径越大,所以X、Z、M、N元素原子半径从大到小的顺序为N>Z>X>M (硅>硫>氧>氢)
