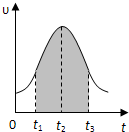
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L•s)]与反应时间t(s)的关系如图所示.回答如下问题:
(1)该反应的化学方程式:______
(2)0→t2时间段内反应速率增大的原因是:______,
(3)t2→t时间段内反应速率减小的原因是:______,
(4)图中阴影部分“面积”表示t1→t3时间里______.
A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
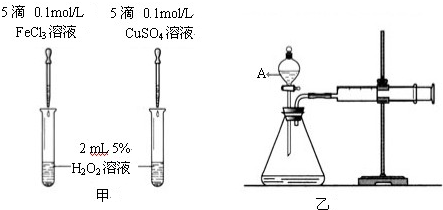
(1)定性分析:如图甲可观察______,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______.
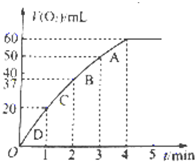
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为______,实验中需要测量的数据是______
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示.设放出气体的总体积为V mL.
①放出
mL气体时所需时间为______min.V 3
②该H2O2溶液的浓度为______
③A、B、C、D各点反应速率快慢的顺序为______>______>______>______.
I(1)该反应的反应物是KMnO4和 H2C2O4,高锰酸钾是强氧化剂,能把草酸氧化成二氧化碳,反应方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,
故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;
(2)该反应是放热反应,温度越高,反应速率越快,所以温度是改变反应速率的主要原因,故答案为:反应放热,温度升高,反应速率加快;
(3)随着反应的进行,反应物的浓度降低,浓度越低,反应速率越小,所以浓度的改变是反应速率变化的主要原因,故答案为:反应物浓度降低,导致反应速率降低;
(4)根据v=
,推倒得v×△t=△C,所以阴影面积表示反应物浓度的减少或生成物浓度的增加,故选AD;△C △t
Ⅱ(1)观察到的现象是:气泡生成的快慢;将FeCl3改为Fe2(SO4)3,两种物质的阴离子相同,只有阳离子相同,判断影响因素更有针对性,故答案为:产生气泡的快慢;消除阴离子不同对实验的干扰;
(2)根据v=
,知需要测量的是气体的体积和时间,故答案为:分液漏斗;产生40mL气体所需的时间;△C △t
(3)①分析图象知,为1min;故答案为:1min;
②设H2O2溶液的浓度为x mol/L
2H2O2
2 H2O+O2 MnO2 .
2 22.4L
xmol/L×0.06L 0.06L
x=0.09
故答案为:0.09mol/L
③图象斜率的大小反映反应速率快慢,斜率越大,反应速率越快,故答案为:D>C>B>A.
