能源、环境与人类的生活和社会发展密切相关.
(1)南海油气资源丰富,石油加工可得到石油液化气,假设某石油液化气的主要成分为C4H10,写出其完全燃烧的化学方程式______;已知相同条件下,相同体积的两种气体分子数相同.小明家欲将石油液气灶改为天然气(主要成分CH4)灶具,如果进燃气管的直径不变,他应将进空气管的直径______(填“增大”或“减小”)
(2)为减少污染、提高煤的利用率,可将其转化为可燃性气体,此过程可认为是在高温下碳与水蒸气的反应,其微观示意图如图所示:
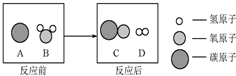
①写出该反应的化学方程式______.
②该反应生成物C和D的分子个数比为______.
(3)为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现NH3燃烧的产物没有污染,且释放大量能量,有一定的应用前景.请将NH3燃烧反应的化学方程式补充完整4NH3+302
6H2O+______.点燃 .
(1)丁烷燃烧能生成二氧化碳和水,2C4H10+13O2
8CO2+10H2O,CH4+2O2点燃 .
CO2+2H2O,根据反应的化学方程式可以看出,当丁烷分子个数为2时,需要氧分子13个,甲烷分子个数为2时,需要氧分子4个,故改成天然气后,空气管需要改小,故填:2C4H10+13O2点燃 .
8CO2+10H2O,减小;点燃 .
(2)①据图可以看出,该反应是碳和水在高温下反应生成一氧化碳和氢气,故填:C+H2O
CO+H2;高温 .
②反应生成的一氧化碳和氢分子的个数比是1:1,故填:1:1;
③4NH3+302
6H2O+X,根据质量守恒定律,反应前含有4个N原子、12个H原子、6个O原子,反应后有12个H原子、6个O原子,故X中含有4个N原子,是2个氮分子,故填:2N2.点燃 .