某同学收集了班级同学“氢气还原氧化铜”实验后的固体残渣(含铜和氧化铜),欲从中回收单质铜和制取硫酸铜溶液,他设计了如下实验方法方案:
(1)称量.称量收集到的固体残渣20g,需要的仪器是______.
(2)溶解.将20g称量好的固体残渣放入烧杯中,加入过量的稀硫酸溶液,用玻璃棒不断搅拌,直至反应完全.烧杯中发生反应的化学方程式为:______.
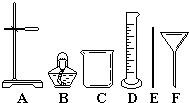
(3)过滤.除滤纸外,还需要从下图选用哪些仪器______(填字母).
(4)洗涤干燥.洗净滤纸上的固体,干燥后称量,此固体名称为______.
(5)收集滤液.滤液中所含溶质的化学式是______.
(6)分析.为了除去滤液中过量的硫酸,应往滤液中加入过量的下列______(填编号)固体粉末,过滤.
①氧化铜 ②氢氧化钠 ③铁 ④硫酸铜
在滤液中加入过量的固体粉末,原因是______;实验现象是______.
(1)称量固体使用的仪器是托盘天平,所以本题答案为:托盘天平;
(2)氧化铜能与硫酸反应生成硫酸铜和水,所以本题答案为:CuO+H2SO4═CuSO4+H2O;
(3)过滤所用的仪器有漏斗、烧杯、玻璃棒和铁架台,故填:A、C、E、F;
(4)铜不与硫酸反应且铜也不溶于水,过滤后铜留在滤纸上;
(5)氧化铜能与硫酸反应生成硫酸铜和水且硫酸过量,故滤液中含有硫酸和生成的硫酸铜,其化学式为为:H2SO4和CuSO4;
(6)要除去滤液中的硫酸,不能引入新的杂质,选用氧化铜比较合适,当硫酸全部参加反应时,加入的氧化铜不再溶解,有固体剩余.
故答案为:(1)托盘天平;(2)CuO+H2SO4═CuSO4+H2O;(3)A、C、E、F; (4)铜;(5)H2SO4和CuSO4;(6)为了使硫酸全部消耗掉、有固体不溶解.
