活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品。用粗ZnO制备活性ZnO的生产工艺流程做如下图所示。
I制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下:
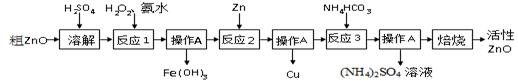
【查阅资料】
1、粗ZnO中常含杂质FeO、CuO
2、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
3、已知:几种物质沉淀时的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去。 | ||||
【问题讨论】
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是___________ __________ _ 。
(2)写出ZnO与加稀硫酸反应的化学方程式 。
(3)反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围是 ,操作A的名称是 。
(4)反应2中加入锌发生的反应属于 反应(填化学反应的基本类型)。
Ⅱ测定碱式碳酸锌的化学式
碱式碳酸锌的化学式是xZnCO3•yZn(OH)2•zH2O,用下列装置测定碱式碳酸锌的化学组成。(假设每步反应、吸收均完全)
提示:碱式碳酸锌xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2三种产物,其中
ZnCO3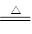 ZnO+CO2↑ Zn(OH)2
ZnO+CO2↑ Zn(OH)2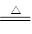 ZnO+H2O
ZnO+H2O
【实验步骤】
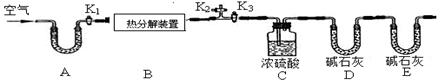
①按图连接好装置,并检查装置的 ;
②在热分解装置中装入68.2g样品,打开活塞 ,关闭 ,缓缓鼓入空气数分钟;
③称量装置C、D的质量;
④关闭活塞K1,K2,打开K3,启动热分解装置,使样品充分热解;
⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
【记录数据】该小组同学按上述实验步骤进行实验,并记录了如下数据:
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是 。
(2)第⑤步继续通空气的目的是 。
(3)E处碱石灰的作用是 ,若没有此装置,测得二氧化碳的质量 (填“偏大”、“偏小”或“无影响”)。
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=
该碱式碳酸锌受热分解的化学方程式为 。
【问题讨论】(1)使氧化锌粗品充分反应 (2)ZnO+H2SO4==ZnSO4+H2O
(3)3.2~5.2 过滤 (4)置换
Ⅱ测定碱式碳酸锌的化学式 ①气密性 ②打开活塞K1、K2 ,关闭 K3
【实验分析及数据处理】(1)除去鼓入空气中的二氧化碳和水蒸气
(2)使反应生成的二氧化碳和水蒸气被完全吸收
(3)防止空气中的二氧化碳和水蒸气进入装置D 偏大
(4) 1:2:1 ZnCO3•2Zn(OH)2•H2O="3ZnO" + CO2↑+2H2O
题目分析:【问题讨论】(1) 溶解前将氧化锌粗品粉碎成细颗粒,目的是:增大反应物的接触面积,使氧化锌粗品充分反应
(2) ZnO与稀硫酸反应的化学方程式:ZnO+H2SO4==ZnSO4+H2O
(3)根据资料3中,几种物质沉淀的PH,反应1的目的将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3 ,为了暂不形成Cu(OH)2、Zn(OH)2 ,该步骤需控制溶液pH的范围是3.2~5.2,操作A是将不溶性固体与液体分离开来,故名称是过滤
(4)反应2是加入锌将铜置换出来,属于置换反应
Ⅱ测定碱式碳酸锌的化学式①按图连接好装置,对反应过程中有气体生产的反应,为了保证气体不泄露,故要检查装置的气密性,②打开活塞K1、K2,关闭 K3,缓缓鼓入空气数分钟
【实验分析及数据处理】(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是除去鼓入空气中的二氧化碳和水蒸气,以免影响产生的二氧化碳和水蒸气质量
(2)第⑤步继续通空气的目的是将残留在装置内的二氧化碳和水蒸气全部排入到质量C、的中,使反应生成的二氧化碳和水蒸气被完全吸收
(3)E处碱石灰的作用是防止空气中的二氧化碳和水蒸气进入装置D,若没有此装置,则空气中的二氧化碳会进入到装置D中,使测得二氧化碳的质量偏大
(4)装置C的作用是吸收生成的水,实验前后质量的质量差=209.2g-198.4g=10.8g,即反应生成水的质量,装置D的作用是吸收生成的二氧化碳,实验前后质量的质量差=244.5g-235.7g=8.8g,即反应后生成二氧化碳的质量,自然可以得出热分解装置中剩余的物质质量=68.2g-8.8g-10.8g=48.6g,即生成的ZnO质量,根据反应ZnCO3△ZnO+CO2↑中ZnCO3、ZnO、CO2微粒个数关系,可得出x=0.2,ZnO的质量=0.2×81=16.2g,则Zn(OH)2△ZnO+H2O这个反应得到的ZnO质量="48.6g-16.2g=32.4" g,根据反应中Zn(OH)2、ZnO、H2O微粒个数关系,可得出y=0.4,H2O的质量=0.4×18=7.2g,故原来水的质量=10.8g-7.2g=3.6g,即微粒个数=0.2,故xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=0.2:0.4:0.2=1:2:1,根据上面求算出来的x、y、z的值,碱式碳酸锌受热分解的化学方程式为:ZnCO3•2Zn(OH)2•H2O△3ZnO + CO2↑+2H2O
