问题
问答题
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为______.
(3)实验①和②的目的是______.实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是______.
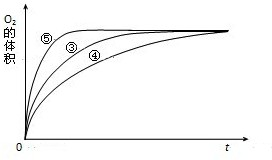
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.
分析上图能够得出的实验结论是______.
答案
(1)催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率,故答案为:降低了活化能;
(2)pH约为6,则电离生成氢离子,溶液显酸性,其电离方程式为H2O2⇌H++HO2-,故答案为:H2O2⇌H++HO2-;
(3)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,
则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(4)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
