教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L-1 H2C2O4溶液 | 30mL 0.01mol•L-1 KMnO4溶液 |
| ② | 20mL 0.2mol•L-1 H2C2O4溶液 | 30mL 0.01mol•L-1 KMnO4溶液 |
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4-)=______mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定______来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、②______.
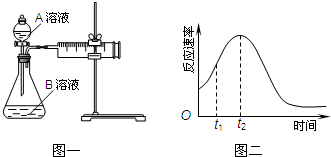
(1)对比①②实验可探究浓度对化学反应速率的影响,②中A溶液的浓度比①中大,化学反应速率大,所得CO2的体积大,故答案为:浓度;②;①;
(2)CO2的物质的量是:4.48mL×10-322.4mol/l=0.0002mol,设2min末,反应(MnO4-)为X
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
X 0.0002mol
解得 X=0.00004mol
30mL×10-3×0.01mol•L-1-0.00004mol=0.00026mol
C(MnO4-)=nv=0.00026mol0.05L=0.0052mol/L
故答案为:0.0052;
(3)通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率,故答案为:KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间;
(4)催化剂能加快化学反应的速率,产物Mn2+(或MnSO4)是反应的催化剂,故答案为:产物Mn2+(或MnSO4)是反应的催化剂.

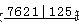 缺失,
缺失, 为健康基牙,进行可摘局部义齿修复,基牙上可设计支持和固位作用都很好的()
为健康基牙,进行可摘局部义齿修复,基牙上可设计支持和固位作用都很好的()