问题
问答题
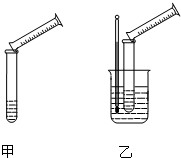
硫代硫酸钠溶液与稀硫酸的反应方程式为:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O,某实验兴趣小组用如图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略).
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究______对化学反应速率的影响.
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
| 实验 组号 | 温度 | Na2S2O3溶液 | H2SO4 | 加入H2O的体积 | 出现沉淀所需时间 | ||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| Ⅰ | 0℃ | 5mL | 0.1mol•L-1 | 10mL | 0.1mol•L-1 | 5mL | 8s |
| Ⅱ | 0℃ | 5mL | 0.1mol•L-1 | 5mL | 0.1mol•L-1 | 10mL | 12s |
| Ⅲ | 30℃ | 5mL | 0.1mol•L-1 | 5mL | 0.1mol•L-1 | 10mL | 4s |
结论2:由Ⅱ和Ⅲ两组数据可知______.
答案
(1)乙中有温度计,温度计的作用是测量溶液的温度,故答案为:温度.
(2)结论1:Ⅰ和Ⅱ两组数据的不同点是稀硫酸的体积、水的体积、出现沉淀的时间,Ⅰ中稀硫酸的浓度比Ⅱ中大,Ⅰ中出现沉淀比Ⅱ中早,所以Ⅰ反应速率比Ⅱ中大,所以其它条件一定时,反应物浓度越大速率越快;
Ⅱ和Ⅲ两组数据的不同点是:Ⅲ的温度比Ⅱ高,Ⅲ出现的沉淀比Ⅱ早,所以,Ⅲ的反应速率比Ⅱ大,所以其它条件一定时,温度越高,速率越快.
故答案为:其它条件一定时,反应物浓度越大速率越快;其它条件一定时,温度越高,速率越快.
