问题
问答题
为减少水污染,实验结束时,同学们利用课余时间处理含有CuSO4、ZnSO4、FeSO4的废液,回收工业重要原料硫酸锌和有关金属.有关资料:
| 物质名称 | 氢氧化钙 | 氢氧化铜 | 氢氧化铁 | 氢氧化锌 | 硫酸钡 | 硫酸钙 |
| 溶解性 | 微溶 | 难溶 | 难溶 | 难溶 | 难溶 | 微溶 |
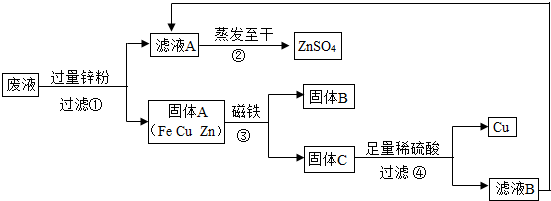
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是______.
(2)写出步骤①其中一个反应的化学方程式______.
(3)步骤①加入的锌粉为什么要过量,请简要说理由______.
(4)要检验步骤④中加入的稀硫酸是否足量的方法是______.
答案
(1)废液中含有硫酸铜、硫酸锌和硫酸亚铁,加入的过量锌粉与硫酸铜和硫酸亚铁反应生成硫酸锌,剩余的锌与硫酸反应生成硫酸锌,所以本题答案为:硫酸锌;
(2)锌排在铁和铜的前面,能与废液中的硫酸铜和硫酸亚铁反应生成硫酸锌,同时生成相应的金属铜和铁,所以本题答案为:Zn+CuSO4=ZnSO4+Cu;
(3)为充分回收硫酸锌和金属铁与铜,需加入过量的锌粉充分反应,所以本题答案为:确保废液中的铁离子和铜离子完全反应;
(4)铁能被磁铁吸引,故C中含有的是锌和铜,锌可以与硫酸反应生成氢气,若有锌剩余则加酸会产生气泡,说明酸量不足,所以本题答案为:取步骤④的滤渣于试管中加入少量稀硫酸,若有气泡产生则酸不足量(或若无气泡产生,则酸已足量).
