问题
填空题
已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
| X | Y | Z | |
| I1 | 496 | 738 | 578 |
| I2 | 4562 | 1451 | 1817 |
| I3 | 6912 | 7733 | 2745 |
| I4 | 9543 | 10540 | 11575 |
(1)三种元素电负性大小关系为 。
(2)写出Y原子的电子排布式 ,Y的第一电离能大于Z的第一电离能的原因 。
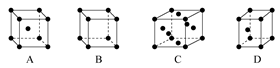
(3)X晶体采用下列 (填字母)堆积方式。
(4)含有元素X的盐的焰色反应为 色。许多金属盐都可以发生焰色反应,其原因是 。
(5)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是 。
答案
(1)Z>Y>X
(2)1s22s22p63s2 Y元素原子最外层s轨道上的电子为全满
(3)A
(4)黄 激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量
(5)MgO>CaO>NaCl>KCl
(1)根据表中数据,X原子中,I2为I1的10倍左右,说明X原子最外层只有一个电子,X是ⅠA族元素;Y原子的I3与I2之间发生突变,则Y原子最外层有2个电子,Y是ⅡA族元素;Z原子的I4≫I3,则Z原子最外层有3个电子,Z属于ⅢA族元素。由于它们在同一周期,X、Y、Z分别为Na、Mg、Al。
