设反应①Fe(S)+CO2(g)⇌FeO(S)+CO(g)的平衡常数为K1.反应②Fe(S)+H2O(g)⇌FeO(S)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③H2(g)+CO2(g)⇌H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K3=______.
(3)根据反应①与②,可推导出K1、K2与K3之间的关系式______.据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应.问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)图1、2表示该反应③在时刻t1达到平衡、在时刻t2分别因改变某个条件而发生变化的情况:
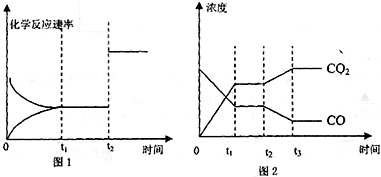
①图1中时刻t2发生改变的条件是______
②图2中时刻t2发生改变的条件是______.
(1)由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,
故答案为:吸;
(2)依据反应CO2(g)+H2(g)=CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:
K3=
,c(CO)•c(H2O) c(H2)•c(CO2)
故答案为:
,c(CO)•c(H2O) c(H2)•c(CO2)
(3)已知:①Fe(s)+CO2(g)⇌FeO(s)+CO(g)
②Fe(s)+H2O(g)⇌FeO(s)+H2(g);△H=Q2,
利用盖斯定律将①-②可得:③H2(g)+CO2(g)⇌CO(g)+H2O(g)
则:K3=
=c(CO)•c(H2O) c(H2)•c(CO2)
=c(CO) c(CO2) c(H2) c(H2O)
,K1 K2
故答案为:K3=
;K1 K2
由表中数据可知,973K时,K3=
=0.62,1173时K3=1.47 2.38
=1.29,则升高温度平衡常数增大,说明升高温度平衡向正反应方向移动,正反应吸热,要使平衡右移,应减少CO的量或升高温度,故选:DF;2.15 1.67
(4)图甲中t2时刻改变条件,正逆反应速率都增大但平衡不移动,改变的条件为增大压强或加入催化剂,图乙中t2时刻改变条件,平衡向逆反应方向移动,二氧化碳浓度增大,一氧化碳浓度减小,可以采用降低温度或增大水蒸气的浓度或减小氢气的浓度,
故选:增大压强或加入催化剂;降低温度或增大水蒸气的浓度或减小氢气的浓度;