汽车内燃机工作时产生的高温会引起N2和O2的反应:N2(g)+O2(g)⇌2NO(g),是导致汽车尾气中含有NO的原因之一.某同学为控制污染,对该反应进行研究.
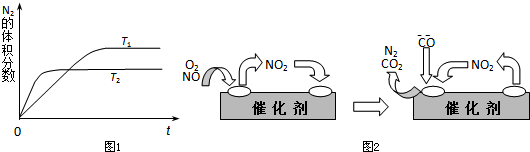
(1)如图1表示在T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图象,根据图象判断反应N2(g)+O2(g)⇌2NO(g)为______(填“吸热”或“放热”)反应.
(2)2000℃时,向容积为2L的密闭容器中充入10molN2与5mol O2,达到平衡后NO的物质的量为2mol,则2000℃时该反应的平衡常数K=______.该温度下,若开始时向上述容器中充入N2与O2均为1mol,则达到平衡后N2的转化率为______.
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式:______.
(1)根据图象判断,T2曲线先到达平衡,反应速率大,温度较高,而温度升高,氮气的体积分数减小,说明升高温度平衡向正反应移动,升高温度向吸热方向进行,故正反应为吸热反应.
故答案为:吸热
(2)利用三段式求出反应混合物各组分物质的量的变化量、平衡时反应混合物各组分物质的量.
N2(g)+O2(g)⇌2NO(g),
起始(mol):10 5 0
反应(mol):1 1 2
平衡(mol):9 4 2
所以平衡常数k=
=[c(NO)]2 c(N2)•c(O2)
=(
)22mol 2L
×9mol 2L 4mol 2L
;1 9
令N2转化的物质的量为xmol,则
N2(g)+O2(g)⇌2NO(g),
起始(mol):1 1 0
反应(mol):x x 2x
平衡(mol):1-x 1-x 2x
所以
=(
)22xmol 2L
×(1-x)mol 2L (1-x)mol 2L
,解得x=1 9
,1 7
N2的转化率为
×100%=14.3%.
mol1 7 1mol
故答案为:
;14.3%1 9
(3)NO2为中间产物,反应物为NO、O2、CO,产物为CO2、N2,反应方程式为2NO+O2+4CO=4CO2+N2.
故答案为:2NO+O2+4CO=4CO2+N2
