问题
实验题
(8分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
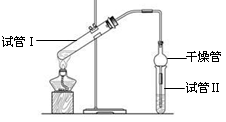
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中 试剂 | 有机层的 厚度/cm |
| A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
| C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
| D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
②分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________。
答案
(共8分)(1)冷凝和防止倒吸(2分)
(2)①3 4 (各1分) ②A C(2分,错选不得分,漏选得1分) (3) 60.6%
(1)应用乙酸和乙醇都是和水互溶的,所以可其防止倒吸的作用,同时也起冷凝作用。
(2)①既然是对照实验,则氢离子的浓度应是相同的,所以盐酸的浓度是4mol/L,体积是3ml。
②根据A和C中生成的乙酸乙酯的量可以判断,浓H2SO4的吸水性提高了乙酸乙酯的产率。
(3)根据反应式CH3COOH+CH3CH2OH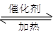 CH3COOCH2CH3+H2O可知,90g乙酸应该消耗乙醇69g,所以理论上应该生成乙酸乙酯是132g,乙醇产率是80=132×100%=60.6%。
CH3COOCH2CH3+H2O可知,90g乙酸应该消耗乙醇69g,所以理论上应该生成乙酸乙酯是132g,乙醇产率是80=132×100%=60.6%。
