五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的气体在水中呈碱性,C和E形成的化合物在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 (填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是 (用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为 ,其中存在的化学键类型为 ;
(4)D最高价氧化物的水化物的化学式为 ;
(5)单质E的原子结构示意图为 ;D在不充足的E中燃烧,生成的主要产物的化学式为 ;
(6)单质E与水反应的离子方程式为 。
(1)Na 、 Cl
(2)PH3
(3)NH4Cl
(4)H3PO4
(5)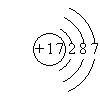 、PCl3
、PCl3
(6)Cl2+H2O=HClO+H++Cl-
题目分析:A和B形成的气体在水中呈碱性,说明A是H,B是N元素;A、B、C、D、E的原子序数依次增大,所以C是Na,D是P元素;C和E形成的化合物在水中呈中性,E是Cl元素。
(1)五种元素中,原子半径最大的是Na,非金属性最强的是Cl;
(2)B、D、E中非金属性最弱的是P,所以与A形成的气态氢化物中稳定性最差的PH3
(3)A和E形成的化合物是氯化氢,A和B形成的化合物是氨气,二者反应生成氯化铵,化学式为NH4Cl
(4) D最高价氧化物的水化物是磷酸,化学式为H3PO4
(5)氯的原子结构示意图为 ,P在不足的氯气中燃烧,生成三氯化磷,化学式为PCl3
,P在不足的氯气中燃烧,生成三氯化磷,化学式为PCl3
(6)氯气和水反应的离子方程式为Cl2+H2O=HClO+H++Cl-
