(22分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)(3分)写出制取乙酸乙酯的化学反应方程式(有机物用结构简式表示):
(2)(3分)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的顺序是:先在试管中加入一定量的 ,然后边加边振荡试管将 加入试管,冷却后再加入 。
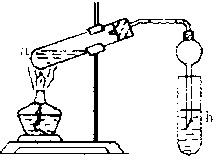
(3)(4分)浓硫酸的作用是:① ;② 。
(4)(3分)饱和碳酸钠溶液的主要作用是 。
(5)(2分)在实验中球形干燥管除起冷凝作用外,另一个重要作用是 。
(6)(2分)若要把制得的乙酸乙酯分离出来,应采用的实验操作叫 。
(7)(2分)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的 。
(8)(3分)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化。
(共22分)(1)(3分)CH3COOH + C2H5OH CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
(2)(3分)乙醇,浓硫酸,乙酸。
(3)(4分)催化剂;吸水剂
(4)(3分)中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯。
(5)(2分)防倒吸。(6)(2分)分液。(7)(2分)防止暴沸。
(8)(3分)②④⑤
本题考查了酯化反应的基本操作及化学平衡状态的判断标准。
(8)平衡状态时正逆反应速率相等,但②③均是只表示了正反应速率,并不能判断是否平衡。



