(10分)“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。回答下列问题
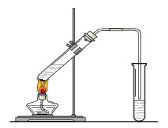
(1)在大试管中按一定比例将乙醇、乙酸混合后充分加热,在右边小试管中未收集到有香味的液体(气密性良好),原因可能是: 。
(2)右边小试管中应加入的试剂是: ;其作用是 。
(3)下列描述能说明乙醇与乙酸的酯化反应已达到该反应的限度的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
(4)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
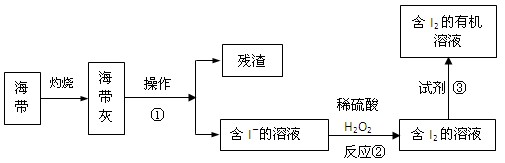
操作①的名称是 ;反应②的离子方程式是 ,下述物质中可做试剂③的是 。
A.乙醇
B.苯
C.乙酸
D.四氯化碳
(1)未加催化剂浓硫酸(1分) (2) 饱和Na2CO3溶液(1分) 中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度。(2分) (3) ②④⑤(2分)
(4) 过滤 (1分) 2H++2I-+H2O2=I2+2H2O(2分)BD(1分)
(1)酯化反应需要浓硫酸作催化剂,根据实验过程可知,实验失败的原因是未加催化剂浓硫酸。
(2)由于生成的乙酸乙酯中含有乙酸和乙醇,所以要除去这两种杂质,需要加入饱和碳酸钠溶液,目的是中和乙酸,溶解乙醇,降低乙酸乙酯的溶解度,便于分层析出。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以④⑤正确。①③中反应速率的方向是相同的,所以不能说明。②中反应速率的方向是相反的,且满足反应速率之比是相应的化学计量数之比,可以说明,所以正确的大答案是②④⑤。
(4)海带灰中含有不溶于水的残渣,过滤即可。双氧水具有氧化性,能把碘离子氧化生成单质碘,所以方程式为2H++2I-+H2O2=I2+2H2O。过程③是萃取,乙酸和乙醇与水都是互溶的,不能用作萃取剂,答案是BD。
