Ⅰ.下列有关操作正确的是 _。
①FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯
②将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验
③用Cu和Ag作为两极,H2SO4溶液作为电解质溶液,可以构成原电池
④为了防止自来水管生锈,一般在表面镀上一层Zn
⑤使用AgNO3溶液验证三氯甲烷中是否含有氯元素,现象是产生白色沉淀
A.②④ B.①② C.③⑤ D.④⑥
Ⅱ. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
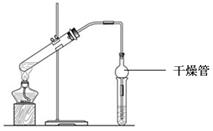
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用
是: 。
(2)已知下表数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | —— | 338 | 1.84 |
A. 先加浓硫酸,再加乙醇,最后加乙酸
B. 先加乙醇,再加浓硫酸,最后加乙酸
C. 先加乙酸,再加浓硫酸,最后加乙醇
D. 先加浓硫酸,再加乙酸,最后加乙醇
②根据上表数据分析,为什么乙醇需要过量一些,其原因是 。
(3)按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
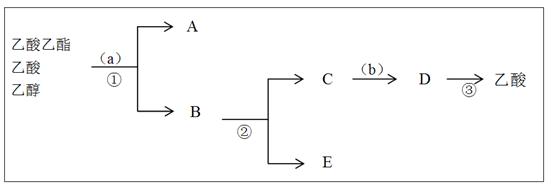
①写出加入的试剂名称: 试剂(a)是 ;试剂(b)是 。
②写出有关的操作分离方法:①是 ,②是 ,③是 。
I. A
II.(1)防倒吸
(2)①B
②乙醇的沸点比乙酸较低,易挥发而损耗
(3)① 饱和碳酸钠溶液 稀硫酸溶液
②分液,蒸馏,蒸馏
题目分析:I.③Cu和Ag都不能与硫酸自发发生氧化还原反应,故不能构成原电池;④自来水管表面镀上一层锌,构成原电池,锌被氧化,保护了铁;⑤AgNO3溶液只能验证氯离子,但三氯甲烷中不存在游离的氯离子,错误。II.乙醇易挥发,故加试剂时乙醇最先加入,并且稍过量;乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,故用分液可分离出A(乙酸乙酯),B为乙醇与乙酸钠的混合物,蒸馏得到低沸点的E(乙醇),C(乙酸钠)加入稀硫酸,发生中和反应生成乙酸和硫酸钠,经蒸馏可得乙酸。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验操作、化学仪器、实验现象等的相关知识的积累。难度较大。
