液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是 。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为 (填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K ,反应速率 (均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是 。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S) d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明 。
(1)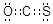 , 极性 (各1分,共2分)
, 极性 (各1分,共2分)
(2)a c (2分)
(3)H2S + 2e → H2↑+S2-(或2H+ + 2e → H2↑)(2分) FeS(1分)
(4)减小,增大(各1分,共2分)
(5)b (2分)
(6)正反应进行程度很大(1分。其他合理答案也给分)
题目分析:(1)羰基硫相当于是二氧化碳中的1个氧原子被硫原子取代,所以其电子式为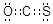 。S和O的非金属性不同,所以该化合物是极性分子。
。S和O的非金属性不同,所以该化合物是极性分子。
(2)a.非金属性越强,最高价氧化物对应水化物的酸性越强,相应的钠盐水解程度越小,所以相同条件下水溶液的pH:Na2CO3>Na2SO4可以碳与硫两元素非金属性相对强弱,a正确;b.非金属性越强,最高价氧化物对应水化物的酸性越强,亚硫酸不是最高价含氧酸,所以酸性:H2SO3>H2CO3不能说明碳与硫两元素非金属性相对强弱,b不正确;c.CS2中碳元素为+4价,硫元素为-2价,说明非金属性是硫强于碳,c正确,答案选ac。
(3)原电池中负极失去电子发生氧化反应,正极得到电子发生还原反应,硫化氢分子中氢元素得到电子,发生还原反应,因此电极反应式为H2S + 2e → H2↑+S2-。负极铁失去电子,生成亚铁离子与硫离子结合生成硫化亚铁,所以负极产物是FeS。
(4)升高温度,会降低羰基硫的转化率,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。则升高温度,平衡常数K减小,而反应速率增大。
(5)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则a.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内气体密度始终保持不变,不能说明反应达到平衡状态,a不正确;b.由于反应在恒容绝热密闭容器中进行,所以容器内温度保持不变可以说明反应达到平衡状态,b正确;c.平衡时浓度不再发生变化,但物质的浓度之间不一定相等,故c(H2)=c(H2S) 不能说明反应达到平衡状态,c不正确;d.υ(H2)正=υ(H2S)正,但二者的反应速率方向相同,所以不能说明反应达到平衡状态,d不正确,答案选b。
(6)平衡常数越大,反应物的转化率越大,因此若该反应的平衡常数很大,说明正反应进行程度很大。
