问题
填空题
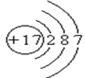
(1)写出氯原子的原子结构示意图
(2)氯元素的原子在反应中易 (填“得”或“失”) 个电子,表现出 性。
(3)氯元素的最高化合价为 ,最低化合价为 。
(4)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(5)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(6)请写出下列物质的电子式。NaCl H2O CO2 N2 。
答案
(1)
(2)得、1、氧化
(3)+7,-1
(4)强
(5) HClO4>H2SO4(2分)
(6)  ;
; ;
;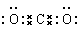 ;
; 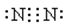
题目分析:(1)氯元素的原子序数是17,位于第三正确第ⅦA族,其原子结构示意图为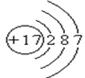 。
。
(2)氯元素最外层电子数是7个,在反应中易得到1个电子,表现出氧化性。
(3)氯元素的最外层电子数是7个,最高价是+7价,最低价是-1价。
(4)氯和硫都是第三周期元素,同周期自左向右非金属性逐渐增强,所以氯元素的非金属性强于硫。
(5)非金属性越强,最高价氧化物对应水化物的酸性越强,所以酸性强弱酸性为 HClO4>H2SO4。
(6)氯化钠是含有离子键的离子化合物,电子式为 ;水是含有极性键的共价化合物,电子式为
;水是含有极性键的共价化合物,电子式为 ;CO2是也是含有极性键的共价化合物,电子式为
;CO2是也是含有极性键的共价化合物,电子式为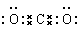 ;氮气是含有非极性键的单质,其电子式为
;氮气是含有非极性键的单质,其电子式为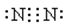 。
。
