下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
| 元素 | 有 关 信 息 |
| A | 元素主要化合价为-2,原子半径为0.074 nm |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
| D | 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
(1)写出C元素在周期表中的位置 ,写出D元素最高价氧化物的水化物电子式 ;
(2)写出B单质与水反应的离子方程式 ;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式 ;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为 ;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为 NA。
(1)第三周期 VIA族; 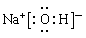 ;
;
(2)Cl2 + H2O Cl-+ H+ + HClO ;
Cl-+ H+ + HClO ;
(3)2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2 ;
(4)酸; NH4++ H2O NH3·H2O + H+ ;
NH3·H2O + H+ ;
(5)O2+2H2O+4e- ="=" 4OH- ;
(6)2.5 。
题目分析:根据题意可知这几种元素分别是A是O;B是Cl;C是S;D是Na;E是N。X是NH4NO3。(1)S元素在周期表中位于第三周期 VIA族。Na元素最高价氧化物的水化物NaOH的电子式为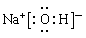 。(2)Cl2与水反应的两种方程式为:Cl2+H2O
。(2)Cl2与水反应的两种方程式为:Cl2+H2O H++Cl-+HClO。(3)元素O和Na形成的化合物Na2O2可作为呼吸面具中氧气的来源,该反应的化学方程式为2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。(4)X NH4NO3是强酸弱碱盐,在溶液中存在水解平衡:NH4++ H2O
H++Cl-+HClO。(3)元素O和Na形成的化合物Na2O2可作为呼吸面具中氧气的来源,该反应的化学方程式为2Na2O2 + 2CO2 ="=" 2Na2CO3 + O2。(4)X NH4NO3是强酸弱碱盐,在溶液中存在水解平衡:NH4++ H2O NH3·H2O + H+,消耗了水电离产生的OH-,使OH-的浓度减小,促进了水的电离,当最终达到电离平衡时,由于溶液中c(OH-)<c(H+).所以其水溶液显酸性。(5)O2的相对分子质量为32,与其等式量的N的氢化物的化学式为N2H4,俗称联氨。燃料N2H4与空气组成的燃料电池中,燃料N2H4为负极,空气的电极为正极。电解质溶液是30%的KOH溶液,则该电池放电时的正极电极反应式为O2+2H2O+4e- ="=" 4OH- 。(6)在整个闭合回路中电子转移的物质的量相等。若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,n(Cu)=80g÷64g/mol=1.25mol,所以n(e-)=2.5mol.即燃料电池中转移的电子数N=2.5NA。
NH3·H2O + H+,消耗了水电离产生的OH-,使OH-的浓度减小,促进了水的电离,当最终达到电离平衡时,由于溶液中c(OH-)<c(H+).所以其水溶液显酸性。(5)O2的相对分子质量为32,与其等式量的N的氢化物的化学式为N2H4,俗称联氨。燃料N2H4与空气组成的燃料电池中,燃料N2H4为负极,空气的电极为正极。电解质溶液是30%的KOH溶液,则该电池放电时的正极电极反应式为O2+2H2O+4e- ="=" 4OH- 。(6)在整个闭合回路中电子转移的物质的量相等。若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,n(Cu)=80g÷64g/mol=1.25mol,所以n(e-)=2.5mol.即燃料电池中转移的电子数N=2.5NA。
