(13分)有A、B、C、D、E、R六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 |
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的1/4 |
| D | 其氢氧化物和氧化物都有两性,且与C同周期 |
| E | 与C同周期,其原子半径在该周期最小 |
| R | 有多种化合价,其最高正价为+6价 |
(1)写出下列元素的名称:C ,E ;画出B的阴离子结构示意图: 。
(2)B、C、D的简单离子半径由大到小的顺序是 (用化学式表示)。E元素的最高价含氧酸的化学式是 ;
(3)实验证明D的氢氧化物(或氧化物)具有两性的操作方法是: 。
(4)在一定条件下,RO32-与R2-可发生反应:RO32-+2R2-+6H+ = 3R+3H2O,下列有关叙述中,正确的是 (填序号)。
A.元素R位于周期表中第3 周期,ⅥA族
B.R2-与氖原子电子层结构相同
C.RO32-在它能发生的所有反应中都只具有氧化性
D.反应中消耗1 mol RO32- ,转移的电子的物质的量为4 mol
(5)请写出涉及上述元素间的两个反应的离子方程式,要求:(1)单质之间的置换 (2)在方程式中如为两种非金属则必须是不同主族的。 ; 。
(1)镁 氯 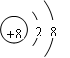 (2) O2->Mg2+>Al3+ ;HClO4
(2) O2->Mg2+>Al3+ ;HClO4
(3)向其氢氧化物(或氧化物)中分别加入足量NaOH溶液、盐酸,固体都能够溶解。 (4)AD ;
(5)Mg+2H+=Mg2++H2↑(或2Al+6H+=2 Al3++3H2↑;或3Mg+2Al3+=3Mg2++2Al)
Cl2+S2-=S↓+2Cl-(或Cl2+H2S=S↓+2Cl-+2H+)
题目分析:根据题意可推知这几种元素分别是:A是H;B是O;C是Mg;D是Al; E是Cl;R是S。(1)C元素的名称是镁;E元素的名称为氯;(2)O、Mg、Al的离子的电子层结构相同,都是2、8的排布。对于电子层结构相同的微粒来说,离子的核电荷数越大,离子的半径就越小。所以简单离子半径由大到小的顺序是O2->Mg2+>Al3+;Cl元素的原子最外层有7个电子,最高化合价为+7价,所以其最高价含氧酸的化学式是HClO4。(3)证明Al(OH)3具有两性的操作方法是向Al(OH)3中分别加入足量NaOH溶液、盐酸,固体都能够溶解。就可证明。(4)A. S的核外电子排布是2、8、6,因此元素R位于周期表中第3 周期,ⅥA族。正确。B.S2-与Ar原子电子层结构相同。错误。C.SO32-在有的反应中具有氧化性,在有的反应中表现还原性。错误。D.根据氧化还原反应中的电子转移数目相等可知在反应RO32-+2R2-+6H+ = 3R+3H2O中,每消耗1 mol RO32- ,转移的电子的物质的量为4 mol。正确。(5)符合题意的两个反应的离子方程式是Mg+2H+=Mg2++H2↑;Cl2+S2-=S↓+2Cl-等。
