(15分)下表中列出五种短周期元素X、Y、Z、W、T的信息。
| 元素 | 相关信息 |
| X | 基态原子最外层电子排布为nsnnpn+1 |
| Y | 其原子L层电子数是K层3倍 |
| Z | 其单质能与冷水剧烈反应,生成的阴阳离子电子数相同 |
| W | 其单质在Y2中燃烧,发出明亮的蓝紫色火焰 |
| T | 其最高正价与最低负价的代数和为6 |
回答下列问题:
(1)Y、Z、W三种元素所形成的简单离子半径由小到大的顺序是 (用离子符号表示);T元素的基态原子核外电子排布式为 。
(2)X、Z两元素可形成化合物ZX3,其晶体中化学键类型有 ,晶体类型为 。
(3)T元素的最高价氧化物对应水化物的化学式是 H2Y的沸点比H2W高的原因是 。
(4) Z2 WY3溶液呈 性,其原因是(用离子方程式表示) 。
(5)已知25℃、101 kPa下:
①2Z(s)+ 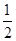 Y2(s)=Z2Y(s) △H1=-414KJ/mol
Y2(s)=Z2Y(s) △H1=-414KJ/mol
②2Z(s)+ Y2(s)=Z2Y2(s) △H1=-511KJ/mol
则1mol Z2 Y2(S)与足量Z(s)反应生成Z2 Y(s)的热化学方程式为 。
(1)Na+<O2-<S2-;1s22s22p63s23p5或【Ne】3s23p5;(2)离子键、共价键;离子晶体;(3)HClO4,水分子间易形成氢键;(4)碱,SO32-+H2O HSO3-+OH-,HSO3-+H2O
HSO3-+OH-,HSO3-+H2O H2SO3+OH-;
H2SO3+OH-;
(5)Na2O2(s)+2Na(s)=2Na2O(s) ∆H= -317KJ/mol
题目分析:根据题意可知:X是N;Y是O;Z是Na;W是S;T是Cl。(1)Na+、O2-的核外电子排布是2、8;而S2-的核外电子排布是2、8、8.对于电子层结构相同的微粒来说,核电荷数越大,离子半径就越小,对于电子层结构不同的微粒来说,电子层数越多,离子半径就越大。故离子半径由小到大的顺序是Na+<O2-<S2-;17号元素Cl元素的基态原子核外电子排布式为1s22s22p63s23p5或【Ne】3s23p5;(2)N与Na两元素可形成化合物NaN3,其晶体中化学键类型有离子键、共价键;其晶体类型为离子晶体;(3)Cl元素的最高价氧化物对应水化物的化学式是HClO4,H2O的沸点比H2S高是因为在水的分子之间存在氢键,增加了分子之间的相互作用。(4) Na2SO3是强碱弱酸盐,水解使溶液呈碱性。水解的两种方程式是SO32-+H2O HSO3-+OH-,HSO3-+H2O
HSO3-+OH-,HSO3-+H2O H2SO3+OH-;①×2-②,整理可得Na2O2 (s) +2Na(s)=2Na2O(s) ∆H= -317KJ/mol。
H2SO3+OH-;①×2-②,整理可得Na2O2 (s) +2Na(s)=2Na2O(s) ∆H= -317KJ/mol。
