(12分)【化学——物质结构与性质】
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,无水合硫酸铜可用作杀菌剂等。
(1)Cu2+的核外电子排布式为________________。
(2)科学家通过X射线测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
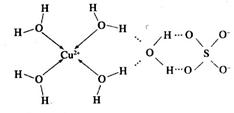
①胆矾的化学式用配合物的形式表示为______。
②胆矾中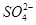 的空间构型为_________,H2O中O原子的杂化方式为____________。
的空间构型为_________,H2O中O原子的杂化方式为____________。
(3)向硫酸铜溶液中加入过量氨水,可生成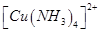 配离子。已知
配离子。已知 的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是____________________________。
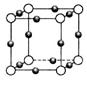
(4)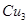 N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
N形成的晶体结构如图所示,N3-的配位数是________。设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为___________(用含a、b的式子表示)。
(1)[Ar]3d9
(2)①[Cu(H2O)4]SO4·H2O ②正四面体型 sp3
(3)F的电负性比N大,N-F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子
(4)6 206/a3b
题目分析:(1)铜为29号元素,其基态原子核外电子排布为[Ar]3d104s1,其中3d和4s轨道分别为全充满和半充满,故Cu2+的核外电子排布为[Ar]3d9;(2)根据胆矾的结构示意图可知Cu2+与4个H2O中的氧原子形成配位键,且其中的2个水分子又与另外一个H2O以氢键结合,然后再与硫酸根以氢键结合,故可表示为:[Cu(H2O)4]SO4·H2O;根据图示可知胆矾中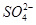 的空间构型应为正四面体型,H2O中O原子的杂化方式为sp3;(3)因为F的电负性比N大,N-F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子;(4)根据晶胞结构可知顶点位置为N3-,楞上为Cu+,故N3-的配位数是6;1个晶胞中含有3个Cu+和1个N3—,故1个晶胞的质量为206/NA g,体积为a3 cm3,所以密度bg/cm3=206/NA g÷a3 cm3,故NA=206/a3b。
的空间构型应为正四面体型,H2O中O原子的杂化方式为sp3;(3)因为F的电负性比N大,N-F成键电子对偏向F原子,使得氮原子上的孤对电子难与Cu2+形成配离子;(4)根据晶胞结构可知顶点位置为N3-,楞上为Cu+,故N3-的配位数是6;1个晶胞中含有3个Cu+和1个N3—,故1个晶胞的质量为206/NA g,体积为a3 cm3,所以密度bg/cm3=206/NA g÷a3 cm3,故NA=206/a3b。
