[化学—物质结构与性质](13分)
Ⅰ.现今运动场馆大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED晶片,材质基本以GaAs(砷化镓)、InGaN(氮化铟镓)为主。砷化镓作为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。
已知砷化镓的晶胞结构如图所示。请回答下列问题:
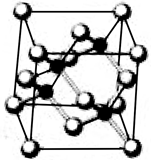
(1)下列说法正确的是 (填字母序号)。
a.砷化镓晶胞结构与NaCl相同 b.第一电离能:As>Ga
c.电负性:As>Ga d.砷化镓晶体中含有配位键
e.GaP与GaAs互为等电子体
(2)AsH3空间构型为__ __;砷化镓可由(CH3)3Ga 和AsH3在700℃时制得,(CH3)3Ga中镓原子的杂化方式为 。
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(3)Cu的价电子排布式为__________;请解释金属铜能导电的原因 。
(4)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中
含有的化学键除普通共价键外,还有 和 。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
(1)b c d e(2分) (2)三角锥型(2分) sp2 (2分)
(3)3d104s1(2分) 金属铜存在自由电子,通电后发生电子的定向移动产生电流(1分)
(4)配位键、离子键(2分) F比H电负性大,吸引电子能力强,电子对强烈偏向于F,故N原子的孤电子对不易与Cu2+形成配位键 (2分)
题目分析::(1)a.GaAs晶体中As分布于晶胞体心,Ga分布于顶点和面心,而NaCl中阴阳离子分别位于晶胞的顶点、面心以及棱和体心,二者结构不同,故a错误;b.同周期元素从左到右第一电离呈增大趋势,但第VA族大于第IIIA族,第IIA族大于第IIIA族,所以则第一电离能:As>Ga,故b正确;c.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故c正确;d.砷价电子数是5个而镓是3个,要满足8电子稳定结构,则 砷化镓晶体中含有配位键,故d正确;e.GaP的价层电子为3+5=8,SiC的价层电子为4+4=8,GaAs价层电子数为3+5=8,则为等电子体,故e正确;故答案为:bcde;(2)AsH3中含有3个δ键和1个孤电子对,为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化;
(3)Cu的原子序数是29,根据核外电子排布规律可知铜的价电子排布式为3d104s1。由于金属铜存在自由电子,通电后发生电子的定向移动产生电流,因此金属铜能导电;
(4)根据物质的结构可知,铜离子与硫酸根离子之间还存在离子键。铜离子与氨气分子间还存在配位键。由于F比H电负性大,吸引电子能力强,电子对强烈偏向于F,故N原子的孤电子对不易与Cu2+形成配位键。
