【物质结构与性质】
某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素
组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的
二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素B、C、D的第一电离能的由大到小排列顺序为 。(用元素符号表示)
(2)D元素原子的最外层电子排布图为 。
(3)该配位化合物的化学式为______,配体的中心原子的杂化方式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 ,分子中含有 个σ键, 个π键。
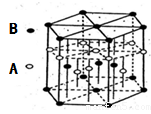
(6)A元素与E元素可形成一种红色化合物,其晶体结构单元如图。则该化合物的化学式为 。该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,写出该反应的化学方程式 。
(1)N>O>S
(2)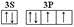
(3)[Cu(NH3)4]SO4•H2O。 sp3杂化
(4)H2O与H2O2之间形成氢键
(5)H-N=N-H;3;1
(6)CuH 2CuH+3Cl2 2CuCl2+2HCl
2CuCl2+2HCl
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14:4:5:1:1,其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-l)dn+6nsl,则n+6=10,故n=4,故其外围电子排布为3d104sl,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可知A为H、B为N,由原子数目之比,可知该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4•H2O。
(1)同主族自上而下第一电离能减小,故O元素第一电离能大于S元素,O与N元素同周期,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于O元素,故第一电离能由大到小的排列顺序为:N>O>S。
(2)D为S元素,其原子的最外层电子排布图为 。
。
(3)由上述分析可知,该配位化合物的化学式为:[Cu(NH3)4]SO4•H2O,配体为NH3,N原子价层电子对数=3+(5−1×3)/2=4,N原子采取sp3杂化。
(4)O元素可与H元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,则为H2O、H2O2,两种化合物可任意比互溶,其主要原因为:H2O与H2O2分子之间存在氢键。
(5)H元素与N元素可形成分子式为N2H2的化合物,该化合物的分子具有平面结构,N原子之间形成N=N双键,N原子与H原子之间形成N-H键,其结构式为H-N=N-H,分子中含有3个σ键,1个π键。
(6)H元素与Cu元素可形成一种红色化合物,由晶体结构单元可知,4个H原子位于内部,6个H原子位于棱上,晶胞中H原子数目=4+6×1/3=6,3个Cu原子为内部,2个位于面心、12个位于顶点,故晶胞中Cu原子数目=3+2×1/2+12×1/6=6,故该化合物的化学式为CuH,该化合物可在氯气中燃烧,生成一种棕黄色固体和一种气体,应生成CuCl2、HCl,反应方程式为:
2CuH+3Cl2 2CuCl2+2HCl。
2CuCl2+2HCl。