分)【化学选修
A-I为原子序数递增的前4周期的元素,已知A原子的最外层电子是次外层电子数的2倍,D为周期表中电负性最大的元素,F与C位于同一主族,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,H为应用最广泛的金属;I处于周期表中的第二副族。请回答下列问题:(以下问题中的所有原子都必须在上述元素中寻找)
(1)B单质分子中 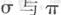 键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
键数目比为____。B、C、D第一电离能由小到大的顺序为__________(填写元素符号)。
(2)H元素原子的价层电子排布式为____,H3+离
子可以与上述元素中的三种形成的某阴离子生成血红色
络合物;该阴离子又与A-I元素中的某些原子形成的分
子互为等电子体,这种分子的化学式为____(写一种即
可).该阴离子空间构型为____。
(3)D与G可以形成下图的晶胞,则黑点表示的是元素____(填写元素符号),该元素原子在该晶胞中的配位数为____.
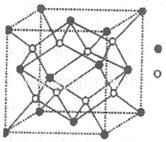
(4)若将上述晶胞圆圈对应的原子所在上下两层平面原子,按两条相互垂直的对角线上各去掉该原子2个(共去掉4个),并将小点和圆圈对应的原子更改为另外两种元素的原子,则这个晶胞化学式为____,若再将留下的所有原子换成另外一种新元素的原子,成为另外一种晶胞,该成键原子键角为 ;(5)已知,F单质晶体的原子堆积为ABAB型,那么,该晶体的空间利用率为____。如果F单质的摩尔质量为M,晶胞棱长为a,晶胞高度为c则,该晶体密度表达式为____。(阿伏加德罗常数用表示,不化简)如果F的原子半径为R,用R表示的晶胞高度为____。
37.(15分) (1)1:2(1分) O<N<F(1分)
(2)3d64s2 (1分) CO2(CS2 N2O)等合理答案都可以(1分) 直线形(1分)
(3)Ca (1分) 8 (1分)
(4)ZnS (2分) 109o28′(1分)
(5)74% (1分);  (2分)
(2分)  (2分)
(2分)
题目分析:A原子的最外层电子是次外层电子数的2倍,故A为碳,D为F,因为氟的电负性最强,则B为N、C为O,F和C在同一族,故F为硫,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,故F和G在第IIA,为镁和钙,应用最广泛的金属H为铁,在第二副族的I为锌;(1)氮气中氮氮三键,有1条ɑ键,故为1:2,同周期第一电离能从左向右逐渐增大,但氮为半充满,稳定,第一电离能大于氧,故为O<N<F;(2)铁的价电子排布为3d64s2,铁离子与SCN-形成络合物,价电子总数为16,分析可得价电子总数为16的分子为 CO2或CS2 或N2O,分析SCN-的结构可得中心原子碳和硫原子形成一条单键和氮原子形成三键,碳原子共形成2条ɑ键,无孤对电子,故为sp1杂化,直线型;(3)黑点位于面心和顶点,8× +6×
+6× =4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a="b=2R," c="1.633a," a="b=90°," g=120°
=4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a="b=2R," c="1.633a," a="b=90°," g=120°
空间利用率=晶胞中球的体积/晶胞体积=  =74.06%;有三个晶胞构成的六棱柱的体积为3a2sin
=74.06%;有三个晶胞构成的六棱柱的体积为3a2sin c,晶胞的质量为
c,晶胞的质量为 ,质量除以体积得密度为:
,质量除以体积得密度为: ;
; 正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 :
正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 :

A3型晶胞中晶轴c 是2个四面体的高,即:c=2AM= 。
。
