(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
元素是 。(均填元素符号)
(2)元素⑦与元素⑧相比,⑧的非金属性较强,下列表述中能证明这一事实的是
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
d.⑦的氧化物的水化物比⑧的氧化物的水化物酸性弱
设计一个简单实验,证明元素⑦与元素⑧的非金属性强弱,只写出反应的化学方程式(不写实验步骤)______________________________________
(3)⑤与⑥两元素最高价氧化物的水化物相互反应的离子方程式为 _____________________________________________________
(4)③的氢化物的电子式为__________________
(5)①④⑤三种元素形成的最简单一种化合物含有的化学键类型有
(共12分)(1)Na Al(每空1分)
(2)b(2分,字母大写不给分)Cl2+Na2S=2NaCl+S↓(2分)
(3)Al(OH)3+ OH-=AlO2-+2H2O(2分)
(4) 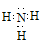 (2分)
(2分)
(5)离子键、共价键(2分)
题目分析:(1)在①~⑨元素中,金属性最强的元素是⑤,为Na元素;氧化物有两性的
元素是⑥Al;
(2)元素非金属性的强弱判断依据是气态氢化物的稳定性、与氢气化合的难易程度、最高价氧化物的水化物的酸性的强弱、单质之间的置换反应。a、c不作为判断依据,错误;b⑧的氢化物比⑦的氢化物稳定,说明⑧的非金属性比⑦强,正确;d、未指明最高价氧化物,错误,答案选b;
(3)⑤与⑥两元素最高价氧化物的水化物分别是氢氧化钠和氢氧化铝,二者反应的离子方程式为
Al(OH)3+ OH-=AlO2-+2H2O;
(4)③为N元素,氢化物是氨气,属于共价化合物,电子式为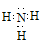 ;
;
(5)①④⑤三种元素分别是H、O、Na,形成的最简单一种化合物是NaOH,含有的化学键类型有离子键、共价键。
