(15分)X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为18,中子数为10 |
| Y | Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的基态原子核外有4个未成对电子 |
(2)Y的电负性比Z 的 (填“大“或”小”);X和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为 。
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式: 。
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式: 。
(1)三周期 ⅦA 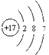 (2)小;H2O (3)2:1
(2)小;H2O (3)2:1
(4)Cl2+2OH—=Cl—+ClO—+H2O;(5)3Fe(s)+2O2(g)=Fe3O4(s) △H=—1118.4kJ·mol—1
题目分析:根据题意可得X是O;Y是S;Z是Cl;W是Fe。(1)Cl元素位于元素周期表第三周期 第ⅦA族。Cl的原子结构示意图是 (2)非金属性S<Cl,元素的非金属性越强,其电负性越大。所以S的电负性比Cl 的小。O和S是同一主族的元素,元素的非金属性O>S。元素的非金属性越强,其氢化物稳定性就越强,所以这两种元素形成气态氢化物中,较稳定的是H2O。(3)在H2O2分子中含有2个H—O极性键和一个O—O非极性健,因此数目之比为2:1。(4)Cl2与NaOH溶液反应制取消毒液的离子方程式是Cl2+2OH—=Cl—+ClO—+H2O;(5)Fe在氧气中燃烧的热化学方程式是3Fe(s)+2O2(g)=Fe3O4(s) △H=—1118.4kJ/mol.。
(2)非金属性S<Cl,元素的非金属性越强,其电负性越大。所以S的电负性比Cl 的小。O和S是同一主族的元素,元素的非金属性O>S。元素的非金属性越强,其氢化物稳定性就越强,所以这两种元素形成气态氢化物中,较稳定的是H2O。(3)在H2O2分子中含有2个H—O极性键和一个O—O非极性健,因此数目之比为2:1。(4)Cl2与NaOH溶液反应制取消毒液的离子方程式是Cl2+2OH—=Cl—+ClO—+H2O;(5)Fe在氧气中燃烧的热化学方程式是3Fe(s)+2O2(g)=Fe3O4(s) △H=—1118.4kJ/mol.。
