(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。
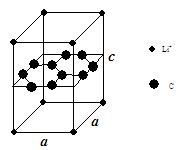
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
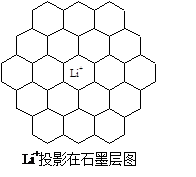
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 | |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
写出BeCO3分解的化学方程式 。
分解温度为什么越来越高? 。
(1) LiC6(2分) LiC6 =Li+ + 6C + e-(2分)
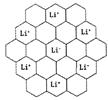 (2分) 离子键(1分)
(2分) 离子键(1分)
(2)120º (1分) sp2(1分)
石墨中一个C-C键平均有0.67个π电子;苯中一个C-C键平均有1个π电子;乙烯中一个C-C键平均有2个π电子;由于π电子从0.67、1增加到2,所以键长缩。(2分)
(3)BeCO3 =" BeO" + CO2↑ (2分)
阳离子半径越小对氧的吸引力越大,夺取氧的能力越强。(2分)
题目分析:
(1)图中晶胞中,Li+离子在8个顶角上,平均为1个,C原子有8个在面上,平均为4,心里有2个,共6个碳原子,故化学式为LiC6,从投影来看,Li+最近的2个Li+都是沿着正六边形的一条边过去的,很容易找到其他6个投影的Li+。
(2)石墨中每个碳原子与其它3个碳原子相连,构成平面结构,故键角为120º,每个碳原子都是sp2(1分);
石墨中一个C-C键平均有0.67个π电子;苯中一个C-C键平均有1个π电子;乙烯中一个C-C键平均有2个π电子;由于π电子从0.67、1增加到2,所以键长缩。(2分)
由表中数据可知在碳酸盐中金属阴离子的半径越小,对氧原子的吸引力越大,夺取氧离子的能力越强。
