(12分)【化学一物质结构与性质】
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l。
(1)在第2周期中,第一电离能大于B的元素有____种。
(2)A的最简单气态氢化物分子的空间构型为________;H2B在乙醇中的溶解度大于H2C,其原因是_______。
(3)AB3,中,A原子轨道的杂化类型是_______ ,与AB3互为等电子体微粒的化学式
为________(写出一种即可)。
(4)D(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程
式_______.
( 5)D2B的晶胞如图所示,已知晶体的密度为  ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、 的式子表示)。
的式子表示)。

(1)3。(2)三角锥型;水分子和乙醇分子间可形成氢键。(3)sp2,CO32—。
(4)Cu(OH)2+4NH3∙H2O [Cu(NH3)4]2++2OH-+4H2O。( 5)
[Cu(NH3)4]2++2OH-+4H2O。( 5)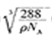 。
。
题目分析:根据题意知,A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,则A为氮元素;元素B的原子最外层电子数是其内层电子数的3倍,则B为氧元素;元素C的一种常见单质为淡黄色粉末,则C为硫元素;D的内层轨道全部排满电子,且最外层电子数为l,则D为铜元素。(1)同周期元素由左向右第一电离能呈增大趋势,但第ⅤA的元素原子p轨道为为半充满状态,较稳定,第一电离能比相邻的ⅣA族和ⅥA族元素大,故在第2周期中,第一电离能大于氧的元素有N、F、Ne共3种。(2)氮的最简单气态氢化物氨分子的空间构型为三角锥型;H2O在乙醇中的溶解度大于H2S,其原因是水分子和乙醇分子间可形成氢键。(3)NO3—中,N原子由3对电子(离子带1个负电荷),轨道的杂化类型是sp2,与NO3—互为等电子体微粒的化学式为CO32—。 (4)Cu(OH)2难溶于水,易溶于氨水,发生络合反应,离子方程式为Cu(OH)2+4NH3∙H2O [Cu(NH3)4]2++2OH-+4H2O。( 5)由Cu2O的晶胞利用切割法分析,1个晶胞含有Cu2+:4个,O2-:8×1/8+1=2个,该晶胞质量=2×160/NAg,该晶胞的密度为ρ g•cm-3,则晶胞边长a=
[Cu(NH3)4]2++2OH-+4H2O。( 5)由Cu2O的晶胞利用切割法分析,1个晶胞含有Cu2+:4个,O2-:8×1/8+1=2个,该晶胞质量=2×160/NAg,该晶胞的密度为ρ g•cm-3,则晶胞边长a=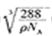 cm。
cm。
