(16分)X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子最外层电子排布式为nsnnpn |
| Y | Y是空气中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的单质是常见的半导体材料 |
(2)Z的单质与W的单质相比熔点较高的是 (写化学式);Z与W原子半径较大的是 (写化学式)
(3)X的一种氧化物XO2分子中σ键与∏键数目之比为
(4)X的第一电离能比W的 (填“大”或“小”)
(5)写出X的单质与Y的最高价氧化物水化物的浓溶液在加热的条件下反应的化学方程式:
(6)已知2.7gZ单质与足量Y单质反应,放出31.8kJ的热量,请写出此反应的热化学方程式: 。
(1)二周期ⅤA族,NH3;(2)Si,Al;(3)1:1;(4)大;
(5)C+4HNO3(浓) 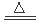 CO2↑+4NO2↑+2H2O;(6)2Al(s)+N2(g)=2AlN(s) ∆H= —636KJ/mol
CO2↑+4NO2↑+2H2O;(6)2Al(s)+N2(g)=2AlN(s) ∆H= —636KJ/mol
题目分析:根据题意可知X是C;Y是N;Z是Al;W是Si。(1)N位于元素周期表的二周期ⅤA族;由于非金属性N>Si。元素的非金属性越强,其简单的氢化物的稳定性就越强。因此稳定性强的是NH3;(2)Al的单质是金属晶体,通过金属键结合,Si的单质是原子晶体,原子间通过共价键结合,由于共价键是一种强烈的相互作用,断裂较难,所以相比熔点较高的是Si。虽然Al原子核外有3个电子层,而Fe原子核外有4个电子层,一般情况下,原子核外电子层数越多,原子半径就越大。但是影响因素的原子半径的大小的因素有很多,与各个轨道含有的电子数、离子的表面积大小等。Al的原子的半径是0.143nm,Fe原子的半径是0.127nm.,所以原子半径较大的是Al;(3)CO2分子的结构式是O=C=O,其中σ键与∏键数目之比为2:2=1:1。(4)由于C的原子半径比Si小,元素的非金属性C>Si,所以C的第一电离能比Si的大。(5)C的单质与浓HNO3在加热的条件下反应的化学方程式:C+4HNO3(浓) CO2↑+4NO2↑+2H2O;(6)根据题意可得热化学方程式为2Al(s)+N2(g)=2AlN(s) ∆H= —636KJ/mol。
CO2↑+4NO2↑+2H2O;(6)根据题意可得热化学方程式为2Al(s)+N2(g)=2AlN(s) ∆H= —636KJ/mol。
