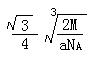【化学—选修3:物质结构和性质】(15分)
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是 ,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ;
(3)请写出X的两种含氧酸的化学式 、 ,其中酸性较强的是 。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。

(15分)
(1)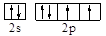 或
或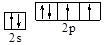 (2分) 氧。(1分)
(2分) 氧。(1分)
(2)sp3(2分),三角锥形。(1分)NH3、PH3(2分,每个1分)
(3)H3AsO3、H3AsO4。(共2分,各1分)H3AsO4(1分)
(4) 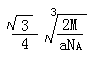 (4分,只要有这个式子即给4分,有无单位或对错均不考虑。)
(4分,只要有这个式子即给4分,有无单位或对错均不考虑。)
题目分析:X元素原子的4p轨道上有3个未成对电子,所以X是第四周期第五主族元素As元素;Y元素原子的最外层2p轨道上有2个未成对电子,则2p上的电子可能是2个也可能是4个,所以Y元素可能是C或O;X跟Y可形成化合物X2Y3,说明Y的化合价为-2价,所以Y是O元素;Z元素既可以形成正一价离子也可形成负一价离子,则Z是H元素。
(1)Y元素原子最外层6个电子,所以价电子的轨道表示式为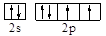 ;该元素是O;
;该元素是O;
(2)在X与Z形成的化合物XZ3中,即AsH3,As的价层电子对数=3+1/2(5-3)=4,所以As是sp3杂化;空间构型为三角锥型;短周期元素形成的化合物中与XZ3互为等电子体的是同主族元素的氢化物NH3、PH3;
(3)As的两种含氧酸的化学式为H3AsO3、H3AsO4。根据酸性强弱的判断依据,同种元素的化合价越高,其含氧酸的酸性越强,所以H3AsO4的酸性强;
(4)由图可知,该晶胞中Q原子的个数是8×1/8+1=2,设晶胞的棱长为xcm,原子半径为rcm,则4r=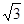 x,根据已知得a=2M/NAx3,可计算出x,所以r=
x,根据已知得a=2M/NAx3,可计算出x,所以r=