【化学—--选修3:物质结构与性质】(15分)
金属铜与金属锰及其化合物在工业上有着广泛的应用:
(1)Cu2+的外围电子排布图可表示为 ;
(2)Mn基态原子核外处在能量最高的能级上的电子共有 种不同的运动状态;
(3)在铜锰氧化物的催化下,空气中CO被氧化成CO2,HCHO被氧化成CO2和H2O
① N3-和CO2是等电子体,则N3-的结构式为 ;
② HCHO分子中C原子轨道的杂化类型为 ;
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 ;
(5) 用晶体的x射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm(提示:3.613=47.05),又知铜的密度为9.00g·cm-3,则铜晶胞的质量是
g(保留两位小数);阿伏加德罗常数为 (列式计算,保留两位小数)。
(1)①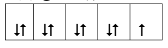 (2分)
(2分)
(2)5(2分)
3d
(3)①[N=N=N]-(2分) ②sp2 (2分)
(4)  (2分)
(2分)
(5) 4.23×10-22g(2分) M(Cu)=64g/mol=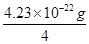 ×NA, NA=6.05×1023mol-1(3分)
×NA, NA=6.05×1023mol-1(3分)
题目分析:(1)Cu2+3d轨道排布了9个电子,所以外围电子排布图可表示为
(2)Mn基态原子核外能量最高的能级为3d,排布了5个电子,有5种不同的运动状态。
(3)①N3-和CO2是等电子体,则N3-的结构与CO2相似,则结构简式为:[N=N=N]-。
②HCHO分子中C原子形成了2个碳氢单键、1个碳氧双键,共3个σ键,所以C原子杂化方式为sp2
(4)OH‾中O原子提供孤对电子,Cu提供空轨道,形成配位键,所以[Cu(OH)4]2-的结构示意图为:
(5)Cu的晶胞为面心立方最密堆积,所以Cu位于顶点和面心上,1个晶胞含Cu:8×1/8+6×1/2=4,则铜晶胞的质量是:4×64÷(6.02×1023)= 4.23×10-22g;一个晶胞为研究对象,则M(Cu)=64g/mol=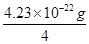 ×NA,可得 NA=6.05×1023mol-1。
×NA,可得 NA=6.05×1023mol-1。
