问题
选择题
下图是周期表中短周期的一部分。已知A、B两元素原子的最外层电子数之和等于E元素原子的最外层电子数。下列有关说法正确的是
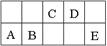
A.元素B和E、B和D形成的化合物在固态时都属于分子晶体
B.工业上可用A、D形成的化合物制取A的单质;B的单质在信息业有广泛用途
C.与E同族的元素中,若简单阴离子的还原性越强,则该元素的最高价氧化物对应水化物的酸性也越强
D.元素B的最简单氢化物分子的空间构型为正四面体,元素C的最简单氢化物的沸点比E的气态氢化物的沸点高
答案
答案:B
题目分析:已知A、B两元素原子的最外层电子数之和等于E元素原子的最外层电子数,根据元素在周期表中的相对位置可知,ABE在第三周期,因此A是铝,B是硅,E是氯,则C是氮,D是氧元素。A、元素B和E、B和D形成的化合物分别是四氯化硅和二氧化硅,前者在固态时属于分子晶体,后者是原子晶体,A不正确;B、工业上电解熔融的氧化铝制取铝单质;硅是半导体材料,在信息业有广泛用途,B正确;C、与E同族的元素中,若简单阴离子的还原性越强,则该元素的非金属性越弱,因此该元素的最高价氧化物对应水化物的酸性也越弱,C不正确;D、元素B的最简单氢化物分子的空间构型为正四面体,水分子间存在氢键,因此元素C的最简单氢化物氨气的沸点比E的气态氢化物水的沸点低,D不正确,答案选B。
