(14分)某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)dn+6nsl,回答下列问题。
(1)元素D在周期表中的位置是 。
(2)该配位化合物的化学式为 。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 。
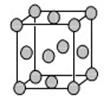
(5)已知E的晶胞结构如下图所示,又知晶胞边长为3.61×10-8cm,则E的密度为 ;EDC4常作电镀液,其中DC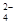 的空间构型是 ,其中D原子的杂化轨道类型是 。
的空间构型是 ,其中D原子的杂化轨道类型是 。
(1)三 (1分)ⅥA(1分) (2)Cu(NH3)4SO4·H2O (2分)
(3)H2O与H2O2之间形成氢键(2分) (4)H-N=N-H (2分)
(5)9.00g·cm-3(2分),正四面体形(2分),sp3杂化(2分)
题目分析:E元素的外围电子排布为(n-1)dn+6nsl,应用s轨道没有排满,则根据洪特规则可知,此时d轨道应该是全充满状态,即n+6=10,解得n=4,所以E元素的原子序数是18+10+1=29,即E是铜元素。某配位化合物为深蓝色晶体,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1。其中C、D元素同主族且原子序数D为C的二倍,因此符合条件的元素是氧元素与硫元素,即C是O,D是S。根据该配位化合物中原子个数比可知,A应该是氢元素,S与O结合生成硫酸根,剩余1个氧原子与2和氢原子结合形成1分子水,则4个B原子结合12个氢原子,即个数之比为1:3,所以该物质是氨气,即B是氮元素。
(1)硫元素在周期表中的位置是第三周期第ⅥA族。
(2)该配位化合物中氨气是配体,因此化学式为Cu(NH3)4SO4·H2O。
(3)氢元素与氧元素形成的两种常见化合物是水和双氧水,由于氧元素非金属性强,H2O与H2O2之间形成氢键,因此二者互溶。
(4)氢元素与氮元素可形成分子式为A2B2的某化合物是N2H2,该化合物的分子具有平面结构,依据8电子和2电子稳定结构可知,氮元素与氮元素之间形成双键,氢元素与氮元素之间形成单键,则其结构式为H-N=N-H。
(5)根据晶胞结构可知,晶胞中含有铜原子的个数是8×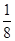 +6×
+6× =4,因此
=4,因此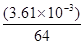 ×6.02×1023=4,解得ρ=9.00g·cm-3。在硫酸根离子中硫原子不存在孤对电子,其价层电子对数是4,所以空间构型是正四面体形,硫原子是sp3杂化。
×6.02×1023=4,解得ρ=9.00g·cm-3。在硫酸根离子中硫原子不存在孤对电子,其价层电子对数是4,所以空间构型是正四面体形,硫原子是sp3杂化。
