[物质结构与性质,13分]
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式 。
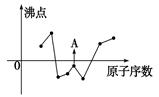
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
| 键长/(pm) | B—F | B—Cl | B—Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
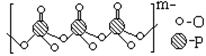
①磷原子的杂化类型为 。
②这种多聚磷酸钠的化学式为 。
(5)已知HF与F-通过氢键结合成HF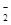 。判断HF
。判断HF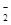 和HF
和HF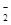 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。
。
(1)[Ar]3d54s1(2分) (2)F2(2分)
(3)平面三角形(1分) B与X原子间还有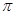 键形成(2分)
键形成(2分)
(4)sp3(2分) Na5P3O10(2分)
(5)在HF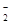 (F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子。(2分)
(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子。(2分)
题目分析:(1)与铜同周期、基态原子最外层电子数相同的过渡元素,为24号元素Cr,其基态原子的电子排布式为[Ar]3d54s1。(2)一般来说,气体的沸点低于0℃,根据曲线知,随着原子序数的递增,连续的有四种元素的单质为气体,即它们应为N、O、F、Ne元素,则单质A应为F2。(3)三氟化硼分子中硼原子以sp2杂化轨道与氟原子成键,三氟化硼分子的空间构型是平面三角形;硼卤键长实测值比计算值要短得多,可能的原因是在B原子上有一个空的2p轨道从三个卤素原子上的任何一个已经充满电子的对称性相同的p轨道接受一对电子形成了π键。(4)①磷原子形成了四个σ键,没有孤电子对,价电子对数为4,故呈sp3杂化;②由给出的多聚磷酸根结构式知,含有3个多聚磷酸根离子,相当于是3个磷酸根离子中去掉了(3-1)氧原子,所带电荷为-2×(3×3+1)+5×3=-(3+2),由化合价规则知磷酸钠的组成为Na5P3O10。(5)在HF(F-H…F-)中,已经存在分子内氢键,所以没有可用于形成氢键的氢原子。
