(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
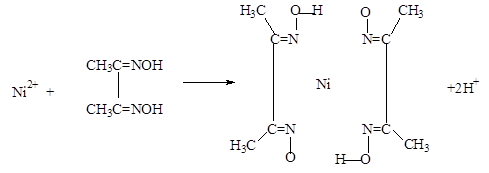
(1) Cu2O ;(2)MgF2为离子晶体,而SiF4为分子晶体,离子晶体熔沸点高于分子晶体
(3)> ;(4)Fe3O4;(5) 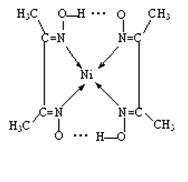
题目分析:(1)在该晶体中含有的O的个数是:8×1/8+1=2;含有的Cu的个数是:4×1=4,Cu:O=4:2=2:1,所以化学式为Cu2O;(2)MgF2为离子晶体,离子间通过离子键结合,离子键是一种强烈的相互作用,断裂消耗较高的能量,而SiF4为分子晶体,分子间通过分子间作用力结合。分子间作用力比化学键弱的多,因此离子晶体熔沸点高于分子晶体。(3)A和B为同一周期的元素。由电离能数据可以看出A的核外电子数比B多,所以原子序数A>B。原子序数越大,元素的非金属性就越强,元素的电负性就越大。因此元素的电负性A>B。(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5中V的未成对电子数是0;CrO2中Cr的未成对电子数是2;Fe3O4中Fe的未成对电子数是4、5,比前两种物质都多。因此更适合作录音带磁粉原料的是Fe3O4;(5)在配合物中化学键和氢键表示为: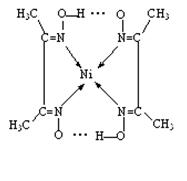 。
。
